题目内容
9.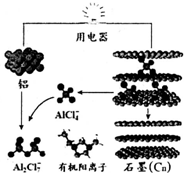 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A.放电时,铝是活泼的金属铝是负极,被氧化生成Al2Cl7-,不活泼石墨为正极,故A正确;
B.阳极性氧化反应,电极反应式为:Cn+AlCl4--e-═Cn[AlCl4],故B正确;
C.放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故C正确;
D.原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故D错误.
故选D.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.

练习册系列答案
相关题目
19.铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
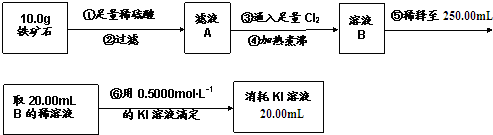
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
17.下表中相关物质的信息都正确的一项是( )
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 | 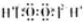 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
4. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3 (用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为FeO和Fe,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
①能判断CO(g)+3H2(g)?CH4(g)+H2O(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$.
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3 (用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$.
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
14.化学与生活和工农业生产密切相关,下列说法不正确的是 ( )
| A. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| B. | 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒 | |
| C. | 废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点 | |
| D. | 聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿 |
1.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性.NCl3的相关性质如下:

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-4-5-2-3-6-710-9-8
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色..
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-4-5-2-3-6-710-9-8
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色..
18.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
19.周期表中有如图所示的元素,下列叙述正确的是( )


| A. | 47.87是丰度最高的钛原子的相对原子质量 | |
| B. | 钛原子的M层上共有10个电子 | |
| C. | 从价电子构型看,钛属于某主族元素 | |
| D. | 22为钛原子的质量数 |
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.