题目内容
4.四氧化三钴(Co3O4)纳米颗粒可以用于人造光合作用,以水和二氧化碳为原料制得甲醇燃料,回答下列问题:(1)二氧化碳的水溶液中含有少量的CO32-,CO32-的空间构型为平面正三角形.
(2)CO2、SiO2为同族元素的氧化物,SiO2熔点高的原因是CO2属于分子晶体,而SiO2属于原子晶体.
(3)甲醇分子中,中心原子的杂化轨道类型为sp3杂化.甲醇易溶于水,其主要原因是甲醇分子与水分子之间形成氢键.
(4)Co3O4晶体结构中,O2-为立方紧密堆积;Co2+为四配位,填充于四面体空隙;Co3+填充于八面体空隙.Co2+的价层电子式为3d7;Co3O4晶体中Co3+的配位数为6.
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2•6H2O),该反应的化学方程式为CoO+2HCl+5H2O=CoCl2•6H2O.
(6)四氧化三钴加热至900℃会分解成氧化亚钴,氧化亚钴的晶体结构与氯化钠类似,若氧化亚钴晶体的晶胞边长为apm,则两个紧邻的Co2+之间的距离为$\frac{\sqrt{2}}{2}$apm.
分析 (1)计算C原子孤电子对数、价层电子对数,进而确定CO32-的空间构型;
(2)CO2属于分子晶体,而SiO2属于原子晶体;
(3)甲醇分子中C原子形成4个共价键,没有孤电子对,杂化轨道数目为4;甲醇分子与水分子之间形成氢键,甲醇易溶于水;
(4)Co为27号元素,原子核外电子排布式为1s22s22p63s23p63d74s2,失去4s能级2个电子形成Co2+;Co3+填充于八面体空隙,则其周围O2-数目为6;
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2•6H2O);
(6)氧化亚钴的晶体结构与氯化钠类似,晶胞中O2-处于体心与棱中心,Co2+处于顶点与面心,若氧化亚钴晶体的晶胞边长为apm,O2-、Co2+之间距离为0.5a pm,顶点与面心的Co2+紧邻,其距离为O2-、Co2+之间距离的$\sqrt{2}$倍.
解答 解:(1)CO32-中C原子孤电子对数=$\frac{4×2-2×3}{2}$=0、价层电子对数=3+0=3,CO32-的空间构型为平面正三角形,
故答案为:平面正三角形;
(2)CO2属于分子晶体,而SiO2属于原子晶体,故SiO2熔点高,
故答案为:CO2属于分子晶体,而SiO2属于原子晶体;
(3)甲醇分子中C原子形成4个共价键,没有孤电子对,杂化轨道数目为4,C原子采取sp3杂化;甲醇分子与水分子之间形成氢键,甲醇易溶于水,
故答案为:sp3杂化;甲醇分子与水分子之间形成氢键;
(4)Co为27号元素,原子核外电子排布式为1s22s22p63s23p63d74s2,失去4s能级2个电子形成Co2+,Co2+的价层电子式为3d7;Co3+填充于八面体空隙,则其周围O2-数目为6,Co3O4晶体中Co3+的配位数为6,
故答案为:3d7;6;
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2•6H2O),该反应方程式为:CoO+2HCl+5H2O=CoCl2•6H2O,
故答案为:CoO+2HCl+5H2O=CoCl2•6H2O;
(6)氧化亚钴的晶体结构与氯化钠类似,晶胞中O2-处于体心与棱中心,Co2+处于顶点与面心,若氧化亚钴晶体的晶胞边长为apm,O2-、Co2+之间距离为0.5a pm,顶点与面心的Co2+紧邻,其距离为O2-、Co2+之间距离的$\sqrt{2}$倍,即两个紧邻的Co2+之间的距离为$\sqrt{2}$×0.5a pm=$\frac{\sqrt{2}}{2}$a pm,
故答案为:$\frac{\sqrt{2}}{2}$a.
点评 本题是对物质结构与性质的考查,涉及空间构型与杂化方式判断、核外电子排布、氢键、晶胞结构及计算等,属于拼合型题目,(6)中计算为易错点,需要学生熟练识记中学常见晶胞结构,具备一定的空间想象与数学计算能力.

| A. | 其密度之比等于对应的物质的量之比 | |
| B. | 其质量之比等于相对分子质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量的倒数之比 | |
| D. | 等体积的三种气体,其物质的量比等于相对分子质量之比 |
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
(2)若①的气态氢化物的水溶液呈碱性,则①在元素周期表中的位置是第二周期VA族;六种元素中,最高价氧化物对应水化物的酸性最强的是Cl(填元素符号).
若②为非金属元素,则以下推断正确的是c(选填编号)
a.①一定是金属元素 b.④一定是金属元素 c.⑥一定是非金属元素.
| A. | c(NH4+):③>① | |
| B. | 水电离出的c(H+):②>① | |
| C. | ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向逆向(填“正向”或“逆向”)进行.
| A. | CH3CH2CH2OH与CH3CH2OCH3 | B. |  与 与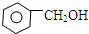 | ||
| C. | CH3COOH与HCOOCH2CH3 | D. | CH3CH2CH2CHO与(CH3)2CHCH2CHO |
| A. | 达到平衡时,4v(O2)正=5v(NO)逆 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |