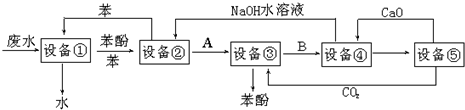
题目内容
12.将K、SiO2、Na2O、NaOH、NaHSO4分别加热熔化,需要克服相同类型作用力的物质有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,离子晶体熔化克服离子键,原子晶体熔化克服共价键,而金属晶体熔化克服金属键,以此来解答.
解答 解:Na2O、NaOH、NaHSO4加热熔化均克服离子键,而SiO2熔化克服共价键,K熔化克服金属键,
故选B.
点评 本题考查化学键及晶体类型,为高频考点,把握不同晶体中化学键及熔化克服非作用力为解答的关键,侧重分析与应用能力的考查,注意晶体类型的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.理论上,不能设计为原电池的化学反应是( )
| A. | 2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)△H<0 | B. | 2FeCl3(aq)+Fe(s)═3FeCl2(aq)△H<0 | ||
| C. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l)△H<0 | D. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H<0 |
3.a在常温下为离子化合物,由X、Y两元素构成,在a中Xm+和Yn-的电子层结构相同.已知下列反应:(1)a+H2O$\stackrel{电解}{→}$H2+b+c (2)H2+c→d(气)(3)b+c→a+e+H2O(4)d+e→a+f,则a、e、f依次是( )
| A. | NaCl NaClO HCl | B. | KCl KClO HClO | ||
| C. | Na2S Na2SO3 H2SO3 | D. | K2S K2SO3 H2SO4 |
20.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Ca2+ K+ Cl- | D. | NO3- K+[Al(OH)4]- H+ |
7.W、X、Y、Z均为短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | 原子半径:W>X | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 阴离子的还原性:W>Z | D. | X与Y不能存在于同一离子化合物中 |
1.实现下列操作的正确方法依次是( )
①分离植物油和水 ②除去KNO3溶液中少量的NaCl杂质 ③以海水为原料制取粗盐.
①分离植物油和水 ②除去KNO3溶液中少量的NaCl杂质 ③以海水为原料制取粗盐.
| A. | 蒸发、萃取、分液 | B. | 分液、结晶、蒸发 | C. | 过滤、蒸发、萃取 | D. | 萃取、过滤、结晶 |
2.下列离子方程式中,书写正确的是( )
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O?H3O++B2- | |
| B. | 电解盐酸:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | NaHCO3的电离:NaHCO3?Na++HCO3- |
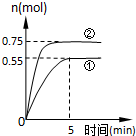 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示: