题目内容
2.下列各组元素中,原子半径依次增大的是( )| A. | Al、Si、P | B. | I、Br、Cl | C. | O、S、Na | D. | Na、Mg、Ba |
分析 电子层数越多,半径越大;
当电子层数相同时,核电荷数越大,半径越小;
当电子层数相同、核电荷数也相同时,核外电子数越多,半径越大,据此分析.
解答 解:A、Al、Si、P的电子层数相同,但核电荷数逐渐增大,故半径逐渐减小,故A错误;
B、I、Br、Cl的电子层数逐渐减小,故半径逐渐减小,故B错误;
C、O的电子层数小于S和Na的电子层数,故O的半径最小;而S和Na的电子层数相同,而Na的核电荷数比S小,故半径比S大,故O、S、Na的半径逐渐增大,故C正确;
D、Na、Mg的电子层数均比Ba的小,故Ba的半径最大;而Na和Mg的电子层数相同,而Na的核电荷数比Mg小,故Na的半径比Mg大,故其中Mg的半径是最小的,故D错误.
故选C.
点评 本题考查了微粒半径的大小比较,难度不大,应注意从电子层数、核电荷数和电子数的顺序来考虑.

练习册系列答案
相关题目
8.下列叙述正确是(用NA 代表阿伏加德罗常数的值)( )
| A. | 2.4g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1mol甲烷分子所含质子数为10NA | |
| C. | 常温常压下,2g氢气含有的分子与32g氧气中分子数目均为NA | |
| D. | 4g氦气所含原子数为2NA |
17.(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
元素M是Al(填写元素符号),该元素属于p区.
(2)硫原子核外有16种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
| I1 | I2 | I3 | I4 | |
| 电离能(kJ•mol-1) | 578 | 1 817 | 2 745 | 11 578 |
(2)硫原子核外有16种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
7.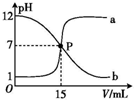 曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )
曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )
 曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )
曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )| A. | 盐酸的物质的量浓度与 NaOH 溶液的物质的量浓度相等 | |
| B. | P 点时溶液中 c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线 b 中滴定前 NaOH 溶液的体积为 150 mL |
14.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
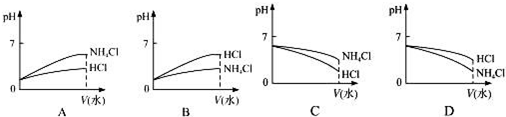
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).
(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
| 实验编号 | 氨水物质的量浓度/ (mol•L-1) | 盐酸物质的量浓度/ (mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).

(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
11.用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 23gNa在氧气中完全燃烧失去NA个电子 | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LH2O含有NA个分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
 .
.
 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到 COOH.现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH.现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是:
COOH的异构体共有7种,其中的3种是: CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,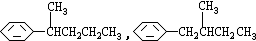
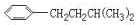 ,
,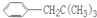 ,
,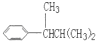 ,
, .
.