题目内容
19.有下列几种物质A.金刚石和石墨
B.C2H6和C5H12
C.苯和

D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
F.C2H4O2和C3H6O2
(1)属于同分异构体的是D;属于同素异形体的是A;属于同系物的是B;属于同位素的是E.
(2)B中C2H6的二氯代物有2种;一氯代物有4种的C5H12的名称是异戊烷.
分析 (1)分子式相同,结构不同的有机物互为同分异构体;
同种元素的不同单质互为同素异形体;
结构相似,分子组成相差n个CH2原子团的有机物互为同系物;
具有相同质子数、不同中子数的原子互为同位素;
(2)据等效氢进行判断一氯代物数目,然后在一氯代物的基础上,继续取代一个氢原子,据此解答;分子式为 C5H12 的烃,它的一氯代物4种,该烷烃中有4种H原子,据此解答.
解答 解:(1)A.金刚石和石墨均是碳元素形成的不同种单质,互为同素异形体;
B.C2H6和C5H12都是烷烃,结构相似,在分子组成上相差1个CH2原子团,互称为同系物;
C.苯和 ,两者的苯环数目不同,结构不同,分子式不同,既不是同系物,也不是同分异构体;
,两者的苯环数目不同,结构不同,分子式不同,既不是同系物,也不是同分异构体;
D.CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,结构不同,互为同分异构体;
E.35Cl和37Cl都是氯元素的不同核素,互为同位素;
F.C2H4O2可能是羧酸或饱和一元酯,C3H6O2可能是羧酸或饱和一元酯,结构不一定相似,不一定是同系物;
故答案为:D;A;B;E;
(2)CH3CH3有1种H原子,其一氯代物有1种:CH2ClCH3,CH2ClCH3有2种H原子,所以二氯代物有2种;
戊烷的同分异构体有:CH3CH2CH2CH2CH3、 、
、 ,在戊烷的各种同分异构体中,一氯代物4种,该烷烃中有4种H原子,故该烷烃为
,在戊烷的各种同分异构体中,一氯代物4种,该烷烃中有4种H原子,故该烷烃为 ,名称为:异戊烷;
,名称为:异戊烷;
故答案为:2;异戊烷.
点评 本题考查“五同”比较以及同分异构体的书写,难度不大,注意体会利用定一移二法书写二元代物.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
9.下列操作中不属于萃取的是( )
| A. | 从青蒿中提取青蒿素 | B. | 从溴水中提取溴单质 | ||
| C. | 浸泡药酒 | D. | 海水淡化 |
10.把500mL有BaCl2和KC1的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L -1 |
7.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1mol醋酸的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧气分子和NA个氢气分子的质量比等于16:1 | |
| C. | 30g乙烷(C2H6)所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积约是11.2L |
4.某化学课外学习小组为研究一种常用于水净化以及工业水处理的物质A的成分,进行了如下探究活动:
(1)查阅资料,获得下列信息:
①化合物A在工业上一般用铝土矿为原料,通过下列流程制备:
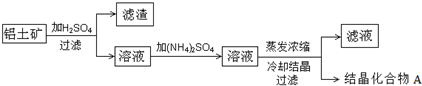
②化合物A是一种白色透明晶体,易溶于热水,水溶液呈酸性;
(2)实验探究:
请根据以上探究结果,回答下列问题:
(1)请写出铝土矿与硫酸主要反应的离子方程式Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O.
(2)结晶水合物A的化学式为NH4Al(SO4)2•12H2O.
(3)A用作净水剂的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(4)气体B可与空气构成燃料电池,生成稳定的单质和水,请写出以KOH为电解质,该燃料电池的负极电极反应式2NH3-6e-+6OH-=N2+6H2O.
(1)查阅资料,获得下列信息:
①化合物A在工业上一般用铝土矿为原料,通过下列流程制备:

②化合物A是一种白色透明晶体,易溶于热水,水溶液呈酸性;
(2)实验探究:
| 实验 | 实验步骤 | 实验结果 |
| ① | 称取9.06g的结晶化合物A加热 | 加热到质量恒定时,质量减轻了4.32g; |
| ② | 将加热后所得的固体分成两等份,分别加适量的水,制成溶液. | |
| ③ | 在一份溶液中加入足量的BaCl2溶液. | 产生4.66g 白色沉淀; |
| ④ | 在另一份溶液中,逐滴加入2mol•L-1的NaOH溶液. | 先观察到产生白色沉淀,接着产生有刺激性气味的气体B,沉淀逐渐溶解,当加入25mL的氢氧化钠溶液时,沉淀恰好完全溶解. |
(1)请写出铝土矿与硫酸主要反应的离子方程式Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O.
(2)结晶水合物A的化学式为NH4Al(SO4)2•12H2O.
(3)A用作净水剂的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(4)气体B可与空气构成燃料电池,生成稳定的单质和水,请写出以KOH为电解质,该燃料电池的负极电极反应式2NH3-6e-+6OH-=N2+6H2O.
11.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.
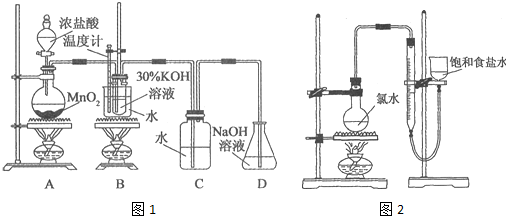
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
①系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响.
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
18.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. |  与 与  | D. |  与 与 |
 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.