题目内容
5.下列离子方程式书写正确的是( )| A. | 用铜电极电解硝酸银溶液:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+ | |
| B. | FeS中加入足量稀硝酸:FeS+2 H+=Fe2++H2↑ | |
| C. | 石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
分析 A.铜为阳极时,阳极铜失去电子,阴极银离子得到电子;
B、硝酸具有氧化性,能将亚铁离子氧化为铁离子;
C、醋酸是弱酸,不能拆成离子的形式;
D、澄清石灰水中通入过量的CO2最终得到澄清的碳酸氢钙溶液.
解答 解:A、用铜片作阴、阳极电解硝酸银溶液,阳极放电的为铜离子,不是水中的氢氧根离子,正确的离子方程式为:2Ag++Cu$\frac{\underline{\;通电\;}}{\;}$2Ag+Cu2+,故B错误;
B、硝酸具有酸性和氧化性,能将亚铁离子继续氧化为铁离子,改写法不符合反应事实,故B错误;
C、石灰石溶于醋酸溶液中:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D、澄清石灰水中通入过量的CO2最终得到澄清的碳酸氢钙溶液,离子方程式为:CO2+OH-=HCO3-,故D正确,
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.乙醇(C2H5OH)和二甲醚(CH3OCH3)互为同分异构体物.且二甲醚不与钠反应,仅含碳、氢、氧三种元素的某化合物,其相对分子质量小于100,其中氧的质量分数为18.18%,已知该化合物不能与钠反应,该化合物的结构共有(不考虑立体异构)
| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
16.在下列实验中,不能达到目的是( )
| A. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性. | |
| B. | 用石墨作电极,电解Cu(NO3)2和AgNO3的混合溶液,证明金属铜和银的金属活动性. | |
| C. | 用加热法分离碘和氯化铵的混合物. | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
20.下列表示除去X中所含杂质的过程.下列方案不能达到目的是( )
X(含杂质)$→_{操作②}^{加入①}$X
X(含杂质)$→_{操作②}^{加入①}$X
| 选项 | X(括号中的物质为杂质) | ① | ② |
| A | 乙酸乙酯(乙醇) | 饱和碳酸钠溶液 | 萃取、分液 |
| B | BaSO4(BaSO3) | 稀硝酸 | 过滤 |
| C | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| D | 铜(铝) | 浓硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
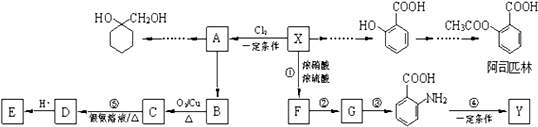
17.对二甲苯(PX)是生产矿泉水瓶(聚对苯二甲酸乙二酯,简称PET)的必要原料,生产涉及的反应之一如下:
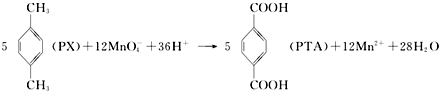
下列有关说法错误的是( )

下列有关说法错误的是( )
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗1molPX,共转移10mol电子 |
15.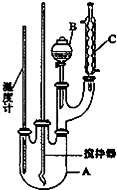 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下:
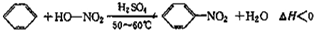
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
实验步骤如下:①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中;②把18mL(15.84g)苯加入A中;③向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束;④将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液;⑤分出的产物加入无水CaCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72.06%.
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: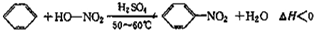
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72.06%.
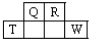 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. ;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑; ;
;
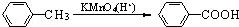
 (苯胺,易被氧化)
(苯胺,易被氧化)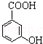 中官能团的名称为酚羟基、羧基;
中官能团的名称为酚羟基、羧基; ;
; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$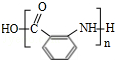 +(n-1)H2O;
+(n-1)H2O; 的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3. 简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂)
简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂) +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl $→_{HCl}^{Sn}$
$→_{HCl}^{Sn}$
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$
 .
. .
. .
.