题目内容
13.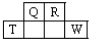 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.(1)T的原子结构示意图是
 ;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;(2)与W同主族的某元素,其氢化物分子中含有18个电子,请写出该氢化物的电子式
 ;
;(3)元素的最高价氧化物所对应的水化物的酸性:Q弱于W(填“强于”或“弱于”),请用化学反应方程式说明原因H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
(4)与R同主族元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式:H3PO3+2OH-═HPO3-+2H2O.
分析 由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素,由此分析解答.
解答 解:(1)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为 ;工业上常用电解熔融的氧化铝制得铝,化学反应方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:
;工业上常用电解熔融的氧化铝制得铝,化学反应方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为: ;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(2)与S同主族的某元素,其氢化物分子中含有18个电子,是过氧化氢,氢化物的电子式为: ,故答案为:
,故答案为: ;
;
(3)元素非金属性越强最高价氧化物对应水化物的酸性越强,非金属性Q<W,而碳酸是弱酸、硫酸是强酸,所以碳酸的酸性弱于硫酸,应用强酸制弱酸,如碳酸钠与硫酸反应,生成二氧化碳气体,方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑,故答案为:弱于,H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
(4)亚磷酸H3PO3是二元弱酸,所以1mol需要2mol的氢氧化钠反应,反应方程式为:H3PO3+2OH-═HPO3-+2H2O,故答案为:H3PO3+2OH-═HPO3-+2H2O.
点评 本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
1.下列说法不正确的是( )
| A. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5 平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
8.下列物质性质与应用对应关系正确的是( )
| A. | 火碱能与酸反应,可用于治疗胃酸过多 | |
| B. | 晶体硅硬度大,可用于制作半导体材料 | |
| C. | SO2具有还原性,可用于漂白纸浆 | |
| D. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
18.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100 mL 1 mol•L-1Na2CO3溶液中阴离子总数大于0.1 NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
5.下列离子方程式书写正确的是( )
| A. | 用铜电极电解硝酸银溶液:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+ | |
| B. | FeS中加入足量稀硝酸:FeS+2 H+=Fe2++H2↑ | |
| C. | 石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
2.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 100 mL 1 mol•L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA | |
| B. | 用惰性电极电解MgCl2溶液,导线中流过2NA个e-时,生成24 g Mg | |
| C. | 标准状况下,11.2 L C2H6中含有极性键的数目为3.5NA | |
| D. | 常温常压下,20 g H218O中含有的中子数目为10NA |
3.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是:H++NO2-═HNO2, 2HNO2═NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol•L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol•L-1NH3•H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A. | A | B. | B | C. | C | D. | D |
 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型.
,其空间构型为直线型.