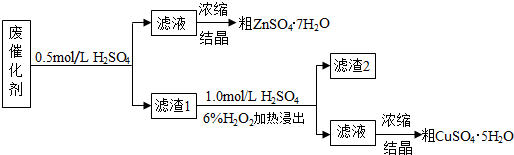
题目内容
15. 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下:
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72.06%.
分析 (1)装置C为球形冷凝管,起冷凝回流作用;
(2)配制混酸应防止液体迸溅;
(3)反应在50℃~60℃下进行,利用水浴加热控制;溶有浓硝酸分解产生的NO2等杂质;
(4)用氢氧化钠洗去溶解少量酸,水洗除去未反应的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,温差过大容易发生炸裂;
(6)根据苯的质量计算硝基苯的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)装置C为球形冷凝管,苯与浓硝酸都以挥发,C起冷凝回流作用,提高原料利用率,
故答案为:冷凝回流;
(2)浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能为导致液体迸溅,
故答案为:不能,容易发生迸溅;
(3)反应在50℃~60℃下进行,低于水的沸点,可以利用水浴加热控制,受热均匀,便于控制温度,浓硝酸受热易分解,溶有浓硝酸分解产生的NO2(或硝酸)等杂质而呈黄色,
故答案为:水浴加热;溶有浓硝酸分解产生的NO2(或硝酸)等杂质;
(4)先用水洗除去浓硫酸、硝酸,再用氢氧化钠除去溶解的少量酸,最后水洗除去未反应的NaOH及生成的盐,
故答案为:洗去残留的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,以免直形冷凝管通水冷却时导致温差过大而发生炸裂,选用空气冷凝管,不选用直形冷凝管,
故答案为:以免直形冷凝管通水冷却时导致温差过大而发生炸裂;
(6)苯完全反应生成硝基苯的理论产量为15.84g×$\frac{123}{78}$,故硝基苯的产率为[18g÷(15.84g×$\frac{123}{78}$)]×100%=72.06%,
故答案为:72.06%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,难度中等,注意操作规范性及仪器作用、渗透安全意识.

| A. | 用铜电极电解硝酸银溶液:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+ | |
| B. | FeS中加入足量稀硝酸:FeS+2 H+=Fe2++H2↑ | |
| C. | 石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是:H++NO2-═HNO2, 2HNO2═NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol•L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol•L-1NH3•H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 | |
| B. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| C. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
是0.0035mol/L;升高温度,NO的浓度增大,则该反应是放 (填“放热”或“吸
热”)反应.
(2)如图中表示NO2变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s)或1.5×10-3mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:25℃、101kPa时,①Mn(s)+O2(g)═MnO2(s)△H1=-520kJ/mol
②S(s)+O2(g)═SO2(g)△H2=-297kJ/mol
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
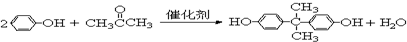
 }及阻燃剂四溴双酚A.合成线路如图:
}及阻燃剂四溴双酚A.合成线路如图:

 $\stackrel{溴化钠、氯化钠、盐酸}{→}$
$\stackrel{溴化钠、氯化钠、盐酸}{→}$
 .
. =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$ =CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
=CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: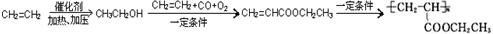 .
. ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
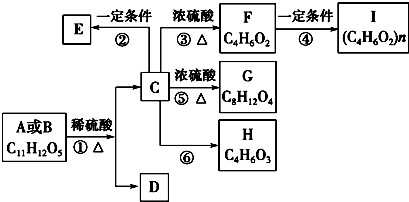
 .
.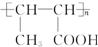
 .
. .
.