题目内容
10.一种重要的有机化工原料有机物X,如图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去).Y是一种功能高分子材料.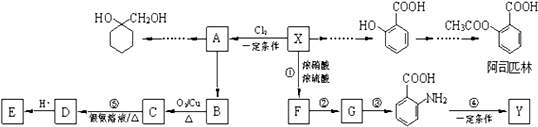
已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:
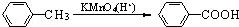
(3)
 (苯胺,易被氧化)
(苯胺,易被氧化)请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为C7H8.
(2)
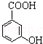 中官能团的名称为酚羟基、羧基;
中官能团的名称为酚羟基、羧基;(3)反应③的反应类型是还原反应;已知A为一氯代物,则E的结构简式是
 ;
;(4)反应④的化学方程式为n
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$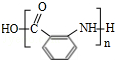 +(n-1)H2O;
+(n-1)H2O;(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有10种:
①含有苯环;②既不能发生水解反应,也不能发生银镜反应;③1mol该有机物能与2molNaHCO3完全反应.
(6)请写出以A为原料制备
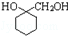 的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$ CH3COOCH2CH3.
分析 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃甲的分子式为C7H8,结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为 ,C为
,C为 ,D酸化生成E,故D为
,D酸化生成E,故D为 ,E为
,E为 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,
, 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为 .
.
解答 解:相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃甲的分子式为C7H8,结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为 ,C为
,C为 ,D酸化生成E,故D为
,D酸化生成E,故D为 ,E为
,E为 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,
, 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为 .
.
(1)通过以上分析知,X分子式为C7H8,故答案为:C7H8;
(2) 中官能团的名称为酚羟基和羧基,故答案为:酚羟基、羧基;
中官能团的名称为酚羟基和羧基,故答案为:酚羟基、羧基;
(3)反应③是硝基转化为氨基,属于还原反应,通过以上分析知,E的结构简式为 ;
;
故答案为:还原反应; ;
;
(4)邻氨基苯甲酸在一定条件下反应生成Y,反应④的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O,
+(n-1)H2O,
故答案为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O;
+(n-1)H2O;
(5)阿司匹林同分异构体满足下列条件:①含有苯环;②既不能发生水解反应,也不能发生银镜反应,说明不含酯基和醛基;③1mol该有机物能与2molNaHCO3完全反应,说明含有两个羧基,可以含有1个取代基为-CH(COOH)2,含有2个取代基为-COOH、-CH2COOH,有邻、间、对3种结构,如果取代基为2个-COOH、1个-CH3,2个-COOH有邻、间、对3种位置,对应的甲基分别有2种、3种、1种位置,所以符合条件的有10种,
故答案为:10;
(6) 在催化剂条件下发生加成反应生成
在催化剂条件下发生加成反应生成 ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成 ,与氯气发生加成反应生成
,与氯气发生加成反应生成 ,最后在氢氧化钠水溶液中发生水解反应生成
,最后在氢氧化钠水溶液中发生水解反应生成 ,合成反应流程图为:
,合成反应流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,根据相对分子质量推断甲的结构是解题的关键,结合A的反应产物的结构特点、反应条件及反应信息利用正推法与逆推法相结合进行判断,是对有机物知识的综合考查,能较好的考查学生的阅读、分析与思维能力,是有机热点题型.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案I.按如图1装置用H2还原无水FeCl2制取.
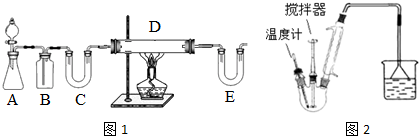
(1)装置C的作用是干燥氢气;E中盛放的试剂是碱石灰;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl.
(2)若温度控制不当,产品中会含单质铁.检验产品中是否含铁的方案是取样,加入盐酸中,观察是否有气泡产生.
Ⅱ.按图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128~139℃加热3h,反应接近100%.冷却,分离提纯得到粗产品.相关反应为2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl.有关数据如下:
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却实验装置,将三颈瓶内物质经过过滤,洗涤沉淀并干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率已达到或超过90%,则烧杯中加入的试剂可以是滴有酚酞且含18gNaOH的溶液.
| A. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5 平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100 mL 1 mol•L-1Na2CO3溶液中阴离子总数大于0.1 NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
| A. | 用铜电极电解硝酸银溶液:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+ | |
| B. | FeS中加入足量稀硝酸:FeS+2 H+=Fe2++H2↑ | |
| C. | 石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
| A. | 100 mL 1 mol•L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA | |
| B. | 用惰性电极电解MgCl2溶液,导线中流过2NA个e-时,生成24 g Mg | |
| C. | 标准状况下,11.2 L C2H6中含有极性键的数目为3.5NA | |
| D. | 常温常压下,20 g H218O中含有的中子数目为10NA |
| A. | 生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 | |
| B. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| C. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
 .
. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为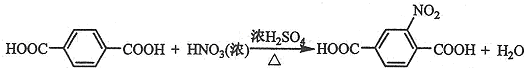 ,该产物的名称是2-硝基-1,4-苯二甲酸.
,该产物的名称是2-硝基-1,4-苯二甲酸.