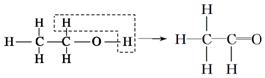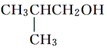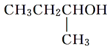题目内容
13.硼氢化钠(NaBH4)在无机合成和有机合成中常用做还原剂.是因为硼氢化钠具有较强 的还原性,能够将羰基选择还原成羟基,但是与碳碳双键、叁键都不发生反应.在酸性条 件下不能稳定存在,但可以在中性或碱性条件下稳定存在,下面有关硼氢化钠说法中正确的是( )| A. | 和 NaOH 含有相同类型的化学键 | |
| B. | 具有还原性是因为其中的钠元素还原性强 | |
| C. | 熔融状态的硼氢化钠能导电 | |
| D. | 硼氢化钠与盐酸混合:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑ |
分析 A、NaOH和NaBH4中含有离子键和共价键;
B、硼氢化钠的还原性是-1价的氢体现出还原性;
C、熔融状态的硼氢化钠中存在自由移动的钠离子和BH4-;
D、硼氢化钠与盐酸混合时硼氢化钠的还原性是-1价的氢与盐酸电离产生氢离子发生归中反应生成氢气.
解答 解:A、NaOH和NaBH4中含有离子键和共价键,所以两者含有相同类型的化学键,故A正确;
B、硼氢化钠的还原性是-1价的氢体现出还原性,而不是钠体现出来的,故B错误;
C、熔融状态的硼氢化钠中存在自由移动的钠离子和BH4-,所以熔融状态的硼氢化钠能导电,故C正确;
D、硼氢化钠与盐酸混合时硼氢化钠的还原性是-1价的氢与盐酸电离产生氢离子发生归中反应生成氢气,化学反应方程式为:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑,故D正确;
故选B.
点评 本题考查了化学键、氧化还原反应方程式的书写等,主要考查了离子键和共价键的辨析,题目难度不大.

练习册系列答案
相关题目
3.吸食或注射毒品会严重危害人体健康,下列都属于毒品的一组物质是( )
| A. | 大麻、鸦片 | B. | 吗啡、胃舒平 | C. | 冰毒、维生素C | D. | 海洛因、阿司匹林 |
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 标准状况下,22.4LH2O含有2NA个共价键 | |
| C. | 常温下,23g NO2含有NA个氧原子 | |
| D. | 1mol ${\;}_{8}^{18}$O2的中子数是20 NA |
1.X、Y、Z、W为四种短周期主族元素,且原子序数依次递增,其中X、Z同主族,Y原子半径是短周期主族元素中最大的,X原子最外层电子数是核外电子层数的3倍,下列说法正确的是( )
| A. | 原子半径:rW>rZ>rY>rX | |
| B. | Z的氢化物比X的氢化物稳定 | |
| C. | X、Y、Z三种元素组成的化合物不止2种 | |
| D. | W元素氧化物对应水化物的酸性一定强于Z |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 电解由Y、Z组成的化合物可获得Z的单质 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 由X、Y组成的化合物只有两种 |
2.下列说法正确的是( )
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 装满SO2气体的试管倒立在滴有紫色石蕊的水槽中,进入试管的液体呈红色 | |
| C. | SO2、漂白粉、活性碳、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
13.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
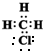 ,
,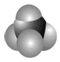 是甲烷的比例模型
是甲烷的比例模型 、
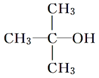
、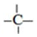 四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2
四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2