题目内容
18.(1)写出-C4H9 对应的所有结构简式CH3-CH2-CH2-CH2-;CH3-CH2(CH3)CH-;(CH3)2CH-CH2-;(CH3)3C-(2)丙烷的六氯代物有4种
(3)一氯甲烷的电子式
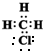 ,
,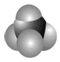 是甲烷的比例模型
是甲烷的比例模型(4)某烷烃分子中同时存在-CH3、-CH2-、
 、
、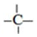 四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2
四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2(5)甲烷-氧气燃料电池,以 NaOH 做电解液,写出负极的电极反应式CH4-8e-+10OH-=CO32-+7H2O.
分析 (1)丁烷的结构简式有2种,据此分析丁基的结构简式;
(2)丙烷的六氯代物的种数和丙烷的二氯代物的种数相同;
(3)一氯甲烷分子中氯原子含有3个孤电子对;能体现物质中各原子大小比例的模型称为比例模型;
(4)如果某烷烃分子中同时存在这4种基团,最少-CH2-、 和
和 各含有一个,剩下的为甲基,根据烷烃通式确定碳原子个数和结构简式,以此解答;
各含有一个,剩下的为甲基,根据烷烃通式确定碳原子个数和结构简式,以此解答;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
解答 解:(1)丁烷的结构简式有2种:CH3-CH2-CH2-CH3和(CH3)2CH-CH3,CH3-CH2-CH2-CH3中H原子有两种,故其形成的丁基有CH3-CH2-CH2-CH2-和CH3-CH2(CH3)CH-;(CH3)2CH-CH3中H原子有两种,故其形成的丁基也有两种:(CH3)2CH-CH2-和(CH3)3C-,故丁基-C4H9 对应的所有结构简式有四种:CH3-CH2-CH2-CH2-;CH3-CH2(CH3)CH-;(CH3)2CH-CH2-;(CH3)3C-;故答案为:CH3-CH2-CH2-CH2-;CH3-CH2(CH3)CH-;(CH3)2CH-CH2-;(CH3)3C-;
(2)丙烷的二氯代物的异构体为:CHCl2CH2CH3,CH3CCl2CH3,CH2ClCHClCH3,CH2ClCH2CH2Cl,
丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物.六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的.氯代物有四种同分异构体,可得到六氯代物也有四种同分异构体.故答案为:4;
(3)一氯甲烷的电子式为: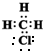 ; 能体现物质中各原子大小比例的模型称为比例模型,故
; 能体现物质中各原子大小比例的模型称为比例模型,故 是甲烷的比例模型,
是甲烷的比例模型,
故答案为: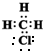 ;比例;
;比例;
(4)如果某烷烃分子中同时存在这4种基团,若要使烷烃碳个数最少,则应-CH2-、 和
和 各含有一个,剩下的为甲基,
各含有一个,剩下的为甲基,
设甲基的个数是x,由烷烃的通式知2(x+3)+2=2+1+3x,x=5,所以最少应含有的碳原子数是8,
该烷烃的结构简式有3种,分别为CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2,故答案为:CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2;
(5)甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
点评 本题考查了有机物结构简式的书写和燃料电池负极电极方程式的书写,应注意的是燃料电池中电解质溶液的不同对电极反应的影响.

| A. | H+、NH4+、Cl-、SO42- | B. | NH4+、K+、NO3-、SO42- | ||
| C. | Mg2+、Ca2+、Cl-、HCO3- | D. | NO3-、Fe2+、H+、SO42- |
| A. | 其一氯代物可能只有一种 | |
| B. | 其分子中的共面原子最多6个 | |
| C. | 可用催化加氢反应除去C4H10中的C4H8 | |
| D. | 等质量的CH4和C4H8分别在氧气中完全燃烧,耗氧量CH4少于C4H8 |

| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 反应产生的热效应Q=E1-E2 | |
| C. | a与b相比,反应的平衡常数一定不同 | |
| D. | a与b相比,a的反应速率更快 |
| A. | 和 NaOH 含有相同类型的化学键 | |
| B. | 具有还原性是因为其中的钠元素还原性强 | |
| C. | 熔融状态的硼氢化钠能导电 | |
| D. | 硼氢化钠与盐酸混合:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑ |
①丙烷的分子式为:CH3CH2CH3
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3?二甲基戊烷
④
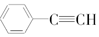 与C8H6互为同分异构体.
与C8H6互为同分异构体.| A. | ①③ | B. | ①②④ | C. | ③④ | D. | ②③ |
| A. | 蛋白质、炭黑、多糖、无机盐 | B. | 塑料、煤炭、多糖、无机盐 | ||
| C. | 多糖、炭黑、蛋白质、无机盐 | D. | 蛋白质、煤炭、多糖、有机玻璃 |
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(2)实验③的目的是验证Cl-是否影响KI与O2的反应.
(3)实验④比②溶液颜色浅的原因是其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱.
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
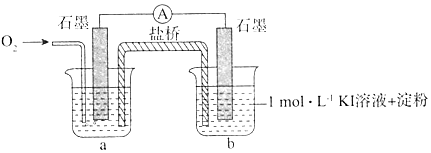
i.烧杯a中的溶液为pH=10的KOH溶液.
ii.实验结果表明,此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b的溶液颜色变深.
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)3I2+6OH-=IO3-+5I-+3H2O.
(5)该小组同学对实验过程进行了整体反恩.推测实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
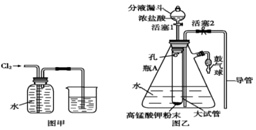 氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器).
氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器).