题目内容
16.由钠、镁、铝、锌4种金属单质中的两种组成的合金共48 g,跟足量的盐酸反应产生22.4 L氢气(标准状况),那么此合金中一定含有的金属是( )| A. | Na | B. | Mg | C. | Al | D. | Zn |
分析 标况下22.4L氢气的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g×$\frac{1mol}{2mol}$=24g,再结合化合价计算提供1mol电子需要各金属的质量,据此判断.
解答 解:标况下22.4L氢气的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,故48g金属提供的电子为:1×2=2mol,则提供1mol电子需要金属的质量为48g×$\frac{1mol}{2mol}$=24g,
A.Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×$\frac{1mol}{1}$=23g,
B.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×$\frac{1mol}{2}$=12g,
C.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×$\frac{1mol}{3}$=9g,
D.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×$\frac{1mol}{2}$=32.5g,
提供1mol电子,只有Zn的质量大于24g,其它金属的质量都小于24g,故金属混合物中一定有Zn,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,注意利用平均值法解答,若有不反应的金属应视作需金属质量无穷大,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法、反渗透法等 | |
| B. | 海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在 | |
| C. | 海生植物如海带中存在较高浓度的I2,具有很高的开发利用价值 | |
| D. | 从海水中可以提取核反应材料 |
11.化学中常借助曲线图来表示某种变化过程,如:①平衡移动过程 ②中和滴定过程 ③沉淀的生成和溶解过程 ④固体物质的溶解度变化过程.下列曲线图中从左到右依次表示上述过程的正确顺序是( )
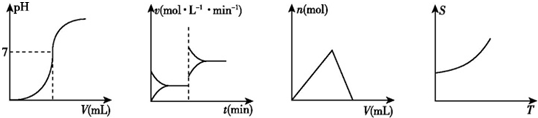

| A. | ①②③④ | B. | ②①③④ | C. | ③②②① | D. | ②③①④ |
1.在一个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
| A. | c(SO3)=0.4 mol/L | B. | c(SO2)=c(SO3)=0.15 mol/L | ||
| C. | c(O2)=0.35 mol/L | D. | c(SO2)+c(SO3)=0.4 mol/L |
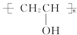 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$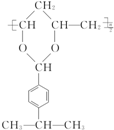
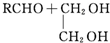 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$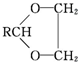 +H2O
+H2O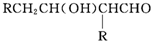 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$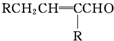
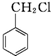 $\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$
$\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$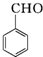
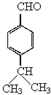 ,E中含有的官能团名称为羟基、醛基.
,E中含有的官能团名称为羟基、醛基.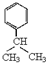 .
.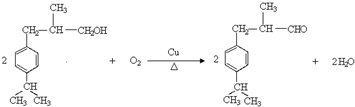 .
. .
.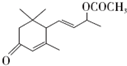 是否互为同分异构体否(填“是”或“否”),符合下列条件的
是否互为同分异构体否(填“是”或“否”),符合下列条件的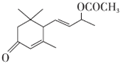 的同分异构体有2种,写出其中一种的结构简式
的同分异构体有2种,写出其中一种的结构简式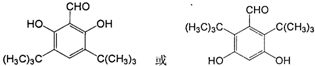 .
.