题目内容
12.空气吹出法是工业规模海水提溴的常用方法,流程如下:浓缩海水$→_{①}^{氯气}$粗产品溴$→_{②}^{通空气和水蒸气}$溴蒸气$→_{③}^{二氧化碳}$物质X$→_{④}^{氯气}$产品溴
下列说法不正确的是( )
| A. | 步骤①中发生的主要反应为Cl2+2Br-═Br2+2Cl- | |
| B. | 步骤②③的目的是富集溴元素 | |
| C. | 物质X 为HBrO | |
| D. | 空气吹出法用到了溴易挥发的性质 |
分析 浓缩海水中加入氯气氧化溴离子为溴单质,通入空气和水蒸气吹出溴蒸气,通入二氧化硫得到物质X为HBr,通入氯气氧化溴化氢得到溴单质.,据此分析选项.
解答 解:A.步骤①中发生的主要反应是氯气和溴离子反应生成溴单质,反应离子方程式为:Cl2+2Br-═Br2+2Cl-,故A正确;
B.步骤②③吹出溴单质后,用二氧化硫还原后再用氯气氧化的目的是富集溴元素,故B正确;
C.分析可知X为HBr,故C错误;
D.热空气吹出溴单质是利用了溴单质易挥发的性质,故D正确;
故选C.
点评 本题考查了海水提溴的过程分析判断,主要是氧化还原反应的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
2.下列反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)═Cu2++2NO3-+2NO2↑+2H2O | |
| B. | 向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
20.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 | |
| C. | 标准状况下,2.24L SO3含有分子的数目为0.1NA | |
| D. | 1mol 硫酸氢钠溶液中含有阳离子数为NA |
1.《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,关于上文的下列说法中正确的是( )
| A. | “洧水”的主要成分是油脂 | B. | “洧水”的主要成分是煤油 | ||
| C. | “洧水”的主要成分是石油 | D. | 其烟的主要成分是石墨 |
16.下列有关物质应用的说法正确的是( )
| A. | 生石灰用作食品抗氧化剂 | |
| B. | 盐类都可作调味品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 小苏打是面包发酵粉的主要成分之一 |

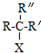 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$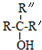 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)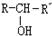 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$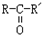 ,
,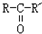 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$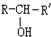
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.