题目内容
4.绿矾(FeSO4•7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体.加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用.(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为7.14mol•L-1(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为>(填>、<、=“)40%“.
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3•nH2O表示20%的发烟硫酸,则n=0.77(保留两位小数).
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为FeSO4•Fe2(SO4)3•10H2O.
(4)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL 2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3SO42-+8NO↑+4H2O
剩余的稀硝酸恰好与V mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3-+3Fe2++4H+=NO↑+3Fe3++2H2O
①V值范围42~60mL.
分析 (1)根据c=$\frac{1000ρw}{M}$计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解出n即可;
(3)根据沉淀9.32克为硫酸钡、氯气的物质的量计算出铁离子和亚铁离子的物质的量、再根据质量关系计算出含有的结晶水的质量,最后计算出晶体的化学式;
(4)①采用极限法计算与固体混合物反应需要的硝酸的物质的量,剩余的硝酸与(NH4)2Fe(SO4)2溶液反应计算需要的(NH4)2Fe(SO4)2溶液的体积;
解答 解:(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为:$\frac{1000×1.4×50%}{98}$mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%,
故答案为:7.14 mol•L-1;>;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解得n=0.77,
故答案为:0.77;
(3)硫酸钡的物质的量为:$\frac{9.32g}{233g/mol}$=0.04mol,即n(FeSO4)+3n(Fe2(SO4)3)=0.04mol,标况下112mL氯气的物质的量为:$\frac{112×1{0}^{-3}L}{22.4L/mol}$=0.005mol,根据反应关系式2Fe2+~Cl2可知,硫酸亚铁的物质的量为:n(FeSO4)=n(Fe2+)=2n(Cl2)0.01mol,则3n(Fe2(SO4)3)=0.04mol-0.01mol=0.03mol,7.32克晶体中结晶水的质量为:m(H2O)=7.32g-152g/mol×0.01mol-400g/mol×0.01mol=1.8g,结晶水的物质的量为:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,所以绿矾晶体中硫酸亚铁、硫酸铜、水的物质的量之比为0.01mol:0.01mol:0.1mol=1:1:10,所以晶体的化学式为:FeSO4•Fe2(SO4)3•10H2O,
故答案为:FeSO4•Fe2(SO4)3•10H2O;
(4)①硝酸的物质的量为:0.20L×2mol/L=0.4mol,
假设固体混合物全部为Cu2S,则n(Cu2S)=$\frac{8.64g}{160g/mol}$=0.054mol,需要是硝酸的物质的量为x,
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
0.054mol x
x=$\frac{0.054mol×16}{3}$=0.288mol,
剩余的硝酸的物质的量为:0.4mol-0.288mol=0.112mol,
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.112mol
解得V=42,
假设固体混合物全部为CuS,则n(CuS)=$\frac{8.64g}{96g/mol}$=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=$\frac{0.09mol×8}{3}$=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol.
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol
解得V=60,
所以V值范围为:42<V<60,
故答案为:42~60mL.
点评 本题考查了物质的量浓度的计算、复杂化学式的确定、化学方程式的计算等知识,题目难度较大,涉及的计算量稍大,注意掌握物质的量概念及表达式,明确根据化学方程式进行计算的方法,其中(4)为难点,涉及到极端讨论法解题.

| A. | CH3-CH=CH2与HCl加成 | |
| B. | CH3-CH2-CHOH-CH3在浓硫酸存在下,发生分子内脱水 | |
| C. | C6H5-CH3在铁粉存在下与氯气反应 | |
| D. | CH3-CHCl-CH3与氢氧化钠醇溶液共热 |
浓缩海水$→_{①}^{氯气}$粗产品溴$→_{②}^{通空气和水蒸气}$溴蒸气$→_{③}^{二氧化碳}$物质X$→_{④}^{氯气}$产品溴
下列说法不正确的是( )
| A. | 步骤①中发生的主要反应为Cl2+2Br-═Br2+2Cl- | |
| B. | 步骤②③的目的是富集溴元素 | |
| C. | 物质X 为HBrO | |
| D. | 空气吹出法用到了溴易挥发的性质 |
| A. | 原电池是将化学能转化为电能的装置,而电解池是将电能转化为化学能的装置 | |
| B. | 电解池的形成条件中要求必须有电源,原电池的形成条件中不要求有电源 | |
| C. | 原电池的负极和电解池的阴极发生的反应类型一样,都是氧化反应 | |
| D. | 原电池的正极和电解池的阴极都是电子流入的一极 |
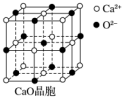 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.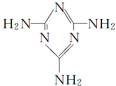 )俗称“蛋白精”,三聚氰酸(
)俗称“蛋白精”,三聚氰酸( 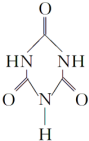 ).
). ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
 ,②的反应类型是取代反应;④的反应类型是还原反应或加成反应.
,②的反应类型是取代反应;④的反应类型是还原反应或加成反应. .
. )的合成路线.
)的合成路线.