题目内容
在3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑中, 是还原剂, 是还原产物,若有11.2L(标准状况)NO气体生成,则转移电子的总数是 .写出该反应的离子方程 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
解答:
解:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑中,Cu元素的化合价升高,则Cu为还原剂,N元素的化合价降低,被还原,则NO为还原产物;有11.2L(标准状况)NO气体生成,转移电子为
×(5-3)×NA=1.5NA,该反应的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,
故答案为:Cu;NO;1.5NA;3Cu+8H++2NO3-=3Cu2++2NO↑+H2O.
| 11.2L |
| 22.4L/mol |
故答案为:Cu;NO;1.5NA;3Cu+8H++2NO3-=3Cu2++2NO↑+H2O.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
 某学生设计了如图的方法对X盐进行鉴定:由此分析,下列结论中不正确的是( )
某学生设计了如图的方法对X盐进行鉴定:由此分析,下列结论中不正确的是( )| A、X中可以有Fe2+ |
| B、Y为AgI沉淀 |
| C、X中可以有Fe3+ |
| D、M试剂可以是H2O2 |
化学中常用图象直观地描述化学反应的进程或结果.下列对图象描述正确的是( )
A、 根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g)的△H>0 |
B、 图表示体积相等、pH=1的醋酸溶液与盐酸加入等量水稀释时的pH变化 |
C、 图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、 图可表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).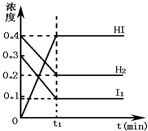 可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:
可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答: 完成下列问题.
完成下列问题.