题目内容
 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答:(1)
(2)我国有些地区有一种说法:“冬天捞碱,夏天晒盐”,这里的碱指Na2CO3,盐是指NaCl.那么图中
(3)人们用上述方法从盐湖中捞得的Na2CO3(常含有少量的NaCl),某研究性学习小组对捞得的碱进行分析,称取Na2CO3固体(含有少量的NaCl)样品12.5g将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,标准状况下共收集到2.24L CO2气体.该反应的化学方程式为
考点:溶液中溶质的质量分数及相关计算
专题:计算题
分析:由溶解度曲线可以:比较同一温度时,两种物质的溶解度大小;根据生活现象分析物质的溶解度的特点,找出与之相对应的溶解度曲线.由摩尔质量的概念可以计算出Na2CO3的摩尔质量;根据化学方程式可以计算出样品中含Na2CO3的物质的量.
解答:
解:(1)t2℃时,A、B两种物质的溶解度交于一点,故它们的溶解度相同,
故答案为:t2;
(2))“冬天捞碱,夏天晒盐”,碳酸钠在冬天从水中析出,说明碳酸钠的溶解度受温度影响比较大,与图中曲线A相似,
故答案为:A;
(3)反应的化学方程式为:2HCl+Na2CO3→2NaCl+H2O+CO2↑,共收集到
=0.1mol CO2气体,则参加反应的Na2CO3的物质的量也为0.1mol,质量为0.1mol×106g/mol=10.6g,质量分数为:
×100%=84.8%,
故答案为:2HCl+Na2CO3→2NaCl+H2O+CO2↑;84.8%.
故答案为:t2;
(2))“冬天捞碱,夏天晒盐”,碳酸钠在冬天从水中析出,说明碳酸钠的溶解度受温度影响比较大,与图中曲线A相似,
故答案为:A;
(3)反应的化学方程式为:2HCl+Na2CO3→2NaCl+H2O+CO2↑,共收集到
| 2.24 |
| 22.4 |
| 10.6 |
| 12.5 |
故答案为:2HCl+Na2CO3→2NaCl+H2O+CO2↑;84.8%.
点评:本题考查固体溶解度曲线所表示的意义、方程式的书写及相关计算,难度不大.通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关含氯化合物的说法正确的是( )
| A、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B、HClO是弱酸,所以NaC1O是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、工业上电解NaCl溶液得到22.4L H2(标准状况),理论上需转移NA个电子 |
 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.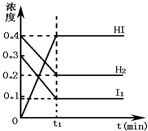 可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:
可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答: 完成下列问题.
完成下列问题.