题目内容
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 46 g钠与氧气完全反应生成Na2O和Na2O2,转移电子数可能为3NA | |
| B. | 向含2 mol FeI2的溶液中通入足量Cl2,消耗氯气分子数为NA | |
| C. | 2 mol Cu与足量硫粉完全反应,转移电子数为2NA | |
| D. | 1 mol Al2Fe(SO4)4固体中含Fe3+的数目为NA |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、1mol FeI2和足量的氯气反应,消耗1.5mol氯气;
C、铜和硫反应后变为+1价;
D、Al2Fe(SO4)4固体中含Fe2+不含Fe3+.
解答 解:A、46g钠的物质的量为2mol,而钠反应后变为+1价,故2mol钠失去2NA个电子,与产物无关,故A错误;
B、1mol FeI2和足量的氯气反应,消耗1.5mol氯气,故2molFeI2消耗3mol氯气,即3NA个氯气分子,故B错误;
C、铜和硫反应后变为+1价,生成Cu2S,故2mol铜转移2NA个电子,故C正确;
D、Al2Fe(SO4)4固体中铁元素为-+2价,即此固体中含的是Fe2+,不含Fe3+,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.钛元素被称为“崛起的第三金属”,已知钛有48Ti、49Ti、50Ti等核素,下列关于金属钛的叙述中不正确的是( )
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素位于元素周期表的d区,属过渡元素 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素在周期表中处于第四周期ⅥB族 |
16.盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
| A. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(OH-) | |
| C. | 10 mL0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
6.在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
| A. | 0.02mol/(L•s) | B. | 1.8mol(L•s) | C. | 1.2mol/(L•s) | D. | 0.18mol/(L•s) |
13.下列各组离子,能在溶液中大量共存的是( )
| A. | Na+、Al3+、OH-、Cl- | B. | Ba2+、H+、SO42-、CO32- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
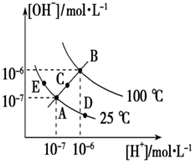 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题: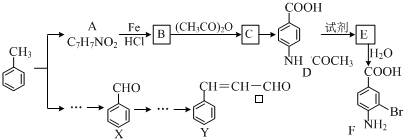
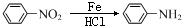
 +(CH3CO)2O→
+(CH3CO)2O→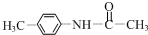 +CH3COOH.
+CH3COOH.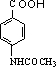 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$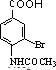 +HBr.
+HBr.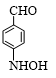 ;
;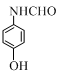 ;
;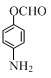 ;
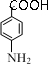
;
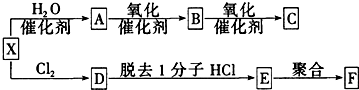
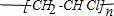 .
.