题目内容
16.盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )| A. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(OH-) | |
| C. | 10 mL0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
分析 A.等物质的量的碳酸氢钠与氢氧化钠反应恰好生成碳酸钠,碳酸根离子部分水解,溶液中一定存在碳酸氢根离子;
B.碳酸氢钠溶液中一定满足电荷守恒和物料守恒,据物料守恒和电荷守恒判断;
C.醋酸钠是强碱弱酸盐,能发生水解,根据电荷守恒和物料守恒判断各种离子浓度之间的关系;
D.醋酸是弱酸,氢离子浓度小于醋酸浓度,根据醋酸和盐酸的物质的量确定消耗氢氧化钠的量.
解答 解:A.在NaHCO3溶液中加入与其等物质的量的NaOH,碳酸氢钠和氢氧化钠恰好反应生成碳酸钠,碳酸钠是强碱弱酸盐能水解,碳酸根离子水解生成碳酸氢根离子,碳酸氢根离子水解生成碳酸,导致溶液中阴离子含有CO32-、OH-、HCO3-,故A错误;
B.碳酸氢钠溶液中根据物料守恒知,c(Na+)=c (H2CO3)+c(HCO3-)+c(CO32-),根据电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),所以c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故B错误;
C.反应后生成醋酸钠,醋酸钠是强碱弱酸盐能水解,醋酸根离子水解导致钠离子浓度大于醋酸根离子浓度,溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,醋酸钠以电离为主水解为次,所以各种离子浓度关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.氯化氢是强电解质,醋酸是弱电解质,pH值相同的盐酸和醋酸,醋酸的浓度远远大于盐酸,所以等体积的盐酸和醋酸,醋酸的物质的量远远大于盐酸的物质的量,中和体积与pH都相同的HCl溶液和CH3COOH溶液,所消耗的NaOH醋酸的多,盐酸的少,故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断、离子浓度大小的比较,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,能运用物料守恒和电荷守恒是解本题的关键.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 紫色石蕊 | B. | 无色酚酞 | C. | pH试纸 | D. | Na2CO3 |
| A. | 46 g钠与氧气完全反应生成Na2O和Na2O2,转移电子数可能为3NA | |
| B. | 向含2 mol FeI2的溶液中通入足量Cl2,消耗氯气分子数为NA | |
| C. | 2 mol Cu与足量硫粉完全反应,转移电子数为2NA | |
| D. | 1 mol Al2Fe(SO4)4固体中含Fe3+的数目为NA |
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
| A. | ①④ | B. | ②⑧ | C. | ③⑤ | D. | ⑥⑦ |

已知各离子沉淀的范围如下表
| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是升高温度或者增大浸取剂浓度等.
(2)溶液1的成分是NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是H2SiO3、Al(OH)3,
此时溶液中的溶质将变成NaHCO3.
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O,2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O.
(4)溶液2调节的pH范围为3.4≤pH<6.7.
(5>对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3.检验红褐色沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净.
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
当两极共产生标准状况下44.8L气体且阴阳两极产生的气体体积之比为1:1时,则析出的铜的质量为64g.
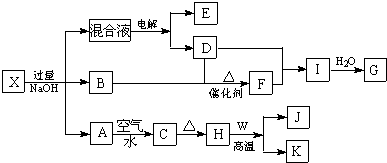
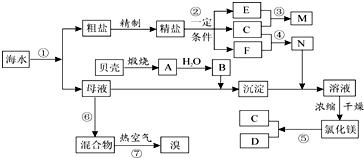

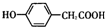 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式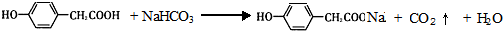 .
.