题目内容
10.过氧化钠是常见的潜艇供氧剂,并且具有强氧化性.(1)请写出Na2O2作为潜艇供氧剂时,其中所发生的一个化学方程式:2Na2O2+2CO2═2Na2CO3+O2,若生成1mol O2,电子转移数目为2NA.
(2)已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应.如2Na2O2+2CO2═2Na2CO3+O2和Na2O2+CO═Na2CO3.试分别写出Na2O2与SO2、SO3反应的化学方程式:2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2.
(3)有一化学兴趣小组将Na2O2投入水中,待完全反应后,滴入酚酞试液,溶液变红,接着又褪色.
甲同学认为是有一部分过氧化钠还未反应完全,过氧化钠具有强氧化性,故将溶液氧化漂白;
乙同学认为Na2O2与水反应先生成氢氧化钠和过氧化氢,过氧化氢具有漂白性,故将溶液氧化漂白.
丙同学认为只要往Na2O2与水完全反应后生成的溶液中先加一种物质,一段时间后再滴入酚酞试液,看溶液变红后是否褪色便可以证明甲乙同学谁的观点正确,你认为丙同学需要加入MnO2.
分析 (1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,氧元素化合价-1价变化为0价和-2价;
(2)由题给信息可知,过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;
(3)过氧化氢在二氧化锰作用下会分解生成氧气和水,在加入酚酞变红色不褪色说明是过氧化氢的氧化性使变红色的溶液褪色,否则是过氧化钠的氧化性作用.
解答 解:(1)Na2O2在潜水艇中作为提供氧气的来源,反应原理为过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
氧元素化合价-1价变化为0价和-2价,若生成1mol O2,电子转移数目为2NA,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;2NA;
(2)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2Na2O2+2SO3═2Na2SO4+O2,
故答案为:2Na2O2+2SO2═2Na2SO4、2Na2O2+2SO3═2Na2SO4+O2;
(3)Na2O2+2H2O=2NaOH+H2O2,往Na2O2与水完全反应后生成的溶液中加入少量二氧化锰,待不再产生气泡,再滴入酚酞试液,溶液只变红不褪色证明过氧化氢的氧化性使变红色的溶液褪色,说明乙同学正确,若变红色后褪色说明是过氧化钠的氧化性说明甲同学正确,
故答案为:MnO2.
点评 本题考查了钠及其化合物性质的分析应用,为高频考点,侧重于学生的分析能力的考查,注意信息的分析判断,化学方程式的书写方法,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.要将BaCl2、NaCl的混合溶液中分别得到纯净的BaCl2和NaCl晶体,在一系列的操作中应选用的试剂是( )
| A. | K2CO3稀盐酸 | B. | Na2CO3 稀盐酸 | C. | Na2CO3稀硫酸 | D. | NaOH 稀盐酸 |
18.科学家合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成,关于此物质说法错误的是( )
| A. | 是烃 | B. | 不能在空气中燃烧 | ||
| C. | 常温下呈固态 | D. | 可能发生加成反应 |
5.下列物质在生活中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 铁粉作食品袋内的脱氧剂 | D. | “84消毒液”杀菌消毒 |
2.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )
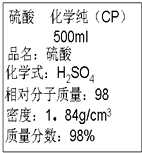

| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
19.下列有关实验装置进行的相应实验,能达到实验目的是( )
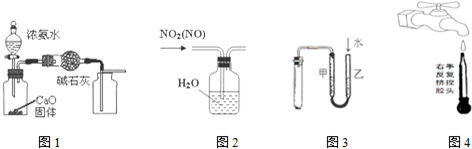

| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置可除去NO2中的NO | |
| C. | 用图3所示装置检验装置的气密性 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
1.下列既能和酸性氧化物反应又能跟碱性氧化物反应,它本身也属于氧化物的是( )
| A. | CO2 | B. | Ca(OH)2 | C. | H2O | D. | CaO |

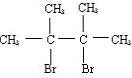
 .
.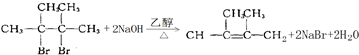 .
.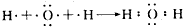 .
.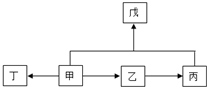 (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: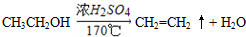 ;
;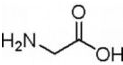 .
.