题目内容
2.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )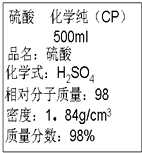
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
分析 A.根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
B.根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;
C.硫酸和水的密度不同,等体积混合后体积不等于硫酸体积的2倍;
D.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,结合质量分数定义,判断质量分数关系.
解答 解:A.浓H2SO4的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.配制200mL 4.6 mol•L-1的稀硫酸,溶液稀释前后溶质物质的量不变,则需要浓硫酸的体积为:$\frac{4.6mol/L×0.2L}{18.4mol/L}$=0.05L=50mL,故B错误;
C.硫酸和水的密度不同,等体积混合后体积小于硫酸体积的2倍,混合后物质的量浓度大于平均值,故C错误;
D.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,根据质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%可知混合后溶液质量分数大于49%,故D正确;
故选D.
点评 本题考查溶液浓度的计算与判断,题目难度中等,注意硫酸的浓度越大,密度越大,明确物质的量浓度与物质质量分数的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12.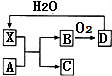 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | X使蔗糖变黑的现象主要体现了X的强氧化性 | |
| B. | 若A为铁,则A与X在室温下不会反应 | |
| C. | 若A为碳单质,则将C通入少量的澄清石灰水中,溶液仍然澄清 | |
| D. | 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D |
7.铜锌原电池工作时,下列叙述正确的是( )
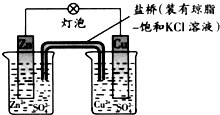

| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 在外电路中,电子从铜片流向锌片 | ||
| C. | 负极发生还原反应 | D. | 盐桥中的K+移向CuSO4溶液 |
14.化学与生活、生产、环境等社会实际密切相关.下列物质性质与应用对应关系正确的是( )
| A. | 铝合金的大量使用,归功于人们用电解法从氧化铝中获取铝 | |
| B. | 铜的活动性比铁弱,故在海轮外壳装铜块减缓海轮腐蚀 | |
| C. | 用电镀厂的废水中直接灌溉农田,可提高水的利用率 | |
| D. | 甲醛溶液具有杀菌消毒的能力,故能用甲醛溶液浸泡食品 |