题目内容
14.回答下列问题:(1)如图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液.
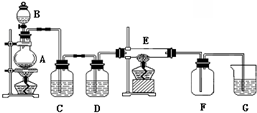
试回答:
①B仪器的名称是:分液漏斗②C装置的作用是除去氯气中的氯化氢
③E中发生反应时的实验现象为产生大量棕红色的烟.
(2)A、B、C、D是中学常见的混合物分离或提纯的基本装置.
实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)
分析 (1)依据仪器形状说出其名称;实验室用浓盐酸与二氧化锰加热制备氯气,浓盐酸易挥发制备的氯气中含有氯化氢和水蒸气,用盛有饱和食盐水的C装置除去氯化氢,用盛有浓硫酸的D装置除去水蒸气,铁与氯气反应生成氯化铁,产生大量棕红色的烟;
(2)四氯化碳浓缩碘水的碘,应用萃取,分液的方法,以此解答.
解答 解:(1)依据B仪器形状可知其为分液漏斗;
实验室用浓盐酸与二氧化锰加热制备氯气,浓盐酸易挥发制备的氯气中含有氯化氢和水蒸气,用盛有饱和食盐水的C装置除去氯化氢,用盛有浓硫酸的D装置除去水蒸气;
铁与氯气反应生成氯化铁,产生大量棕红色的烟;
故答案为:①分液漏斗;
②除去氯气中的氯化氢;
③产生大量棕红色的烟;
(2)碘不易溶于水,易溶于四氯化碳,则利用萃取、分液法分离,
故答案为:C.
点评 本题考查了氯气的实验室制备和性质检验、混合物分离提纯方法的选择和应用,为高频考点,熟悉实验室制备氯气的原理及氯气的性质、把握物质的性质、性质差异及常见混合物分离方法和装置为解答的关键,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
5.已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242 kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484 kJ•mol-1 |
19.下列说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 | |
| D. | 吸热反应在常温条件下一定不会发生 |
6.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |




 ;
; .
.