题目内容
4.称取KCl试样0.1972g,溶解后用0.1mol•L-1的AgNO3标准溶液滴定,用去22.62ml,求试样中KCl的百分含量.分析 先根据n=cV计算出消耗硝酸银的物质的量,然后根据反应方程式计算出样品中含有氯化钾的物质的量,再根据m=nM计算出KCl的质量,从而可计算出该样品中氯化钾的百分含量.
解答 解:22.62mL 0.1mol•L-1的AgNO3标准溶液中含有硝酸银的物质的量为:0.1mol/L×0.02262L=0.002262mol,
根据反应方程式AgNO3+KCl=AgCl↓+KNO3可知,该氯化钾样品中含有氯化钾的物质的量为0.002262mol,质量为:74.5g/mol×0.002262mol=0.168519g,
该氯化钾样品中KCl的百分含量为:$\frac{0.168519g}{0.1972g}$×100%≈85.5%,
答:试样中KCl的百分含量为85.5%.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量的之比为1:2,则下列说法中一定不正确的是( )
| A. | 分子不可能是烷烃 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
9.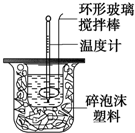 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
①温度差平均值为3.4℃.近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该中和反应的反应热△H=-56.8kJ/mol( 保留一位小数);
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
16.东晋葛洪在《抱朴子》中写道“扶南生金刚,生水底石上,如钟乳状,体似紫石英,可以刻玉,人没水取之,虽铁椎之亦不能伤.”文中所述“金刚”可能为( )
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
3.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法不正确的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X2>Y>Z | D. | 原子最外电子层上电子数不相等 |
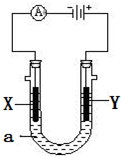 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: ;
;