题目内容
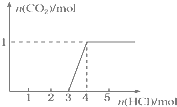 一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )| A、通入的CO2气体在标准状况下的体积约为22.4 L |
| B、原溶液中c(NaOH)=2mol/L |
| C、A溶液中含Na2CO3和NaHCO3 各1mol |
| D、A溶液中含有2molNaOH和1mol Na2CO3 |
考点:化学方程式的有关计算
专题:计算题
分析:由图象可知,加入盐酸3mol时,开始生成CO2,共消耗1molHCl,发生NaHCO3+HCl=NaCl+CO2↑+H2O,如开始加入盐酸时中发生Na2CO3+HCl=NaCl+NaHCO3,则应消耗1mol盐酸,但至开始生成二氧化碳时消耗3mol盐酸,则说明溶液中含有NaOH和Na2CO3,开始时先后发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,结合方程式计算解答该题.
解答:
解:由图象可知,加入盐酸3mol时,开始生成CO2,共消耗1molHCl,发生NaHCO3+HCl=NaCl+CO2↑+H2O,如开始加入盐酸时中发生Na2CO3+HCl=NaCl+NaHCO3,则应消耗1mol盐酸,但至开始生成二氧化碳时消耗3mol盐酸,则说明溶液中含有NaOH和Na2CO3,开始时先后发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,
A.由图象可知生成二氧化碳1mol,由碳元素守恒可知,通入的CO2气体在标准状况下应为1mol×22.4L/mol=22.4L,故A正确;
B.开始时先后发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,共消耗3molHCl,由于最终得到二氧化碳1mol,故碳酸钠为1mol,其中碳酸钠消耗1molHCl,故氢氧化钠消耗2molHCl,即剩余氢氧化钠为2mol,原溶液中n(NaOH)=2mol+1mol×2=4mol,则原溶液中c(NaOH)=
=2mol/L,故B正确;
C.由B中分析可知,A溶液中含有1molNa2CO3和2molNaOH,故C错误;
D.由B中分析可知,A溶液中含有1molNa2CO3和2molNaOH,故D正确.
故选C.
A.由图象可知生成二氧化碳1mol,由碳元素守恒可知,通入的CO2气体在标准状况下应为1mol×22.4L/mol=22.4L,故A正确;
B.开始时先后发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,共消耗3molHCl,由于最终得到二氧化碳1mol,故碳酸钠为1mol,其中碳酸钠消耗1molHCl,故氢氧化钠消耗2molHCl,即剩余氢氧化钠为2mol,原溶液中n(NaOH)=2mol+1mol×2=4mol,则原溶液中c(NaOH)=
| 4mol |
| 2L |
C.由B中分析可知,A溶液中含有1molNa2CO3和2molNaOH,故C错误;
D.由B中分析可知,A溶液中含有1molNa2CO3和2molNaOH,故D正确.
故选C.
点评:本题考查混合物的计算、图象数据的处理知等,难度中等,根据图象判断溶质及各段发生的反应是解题的关键.

练习册系列答案
相关题目
 一些简单原子的原子结构可用如图①、②、③形象地表示:根据该图的示意,则下列有关图①、②、③所表示的原子叙述正确的是( )
一些简单原子的原子结构可用如图①、②、③形象地表示:根据该图的示意,则下列有关图①、②、③所表示的原子叙述正确的是( )| A、①②③互为同位素 |
| B、①②③互为同素异形体 |
| C、①②③为同种原子 |
| D、①②③具有相同的质量数 |
下列各组元素按从左到右的顺序,原子序数递增、元素的最高正化合价也递增的是( )
| A、C、N、O、F |
| B、Na、Be、B、C |
| C、P、S、Cl、Ar |
| D、Na、Mg、Al、Si |
下列说法中正确的是( )
| A、吸热反应中的反应速率比较小 |
| B、吸热的化学反应不加热就不能发生 |
| C、放热的化学反应不需要加热就能发生 |
| D、化学反应有物质变化,还伴随着能量变化 |
下列说正确的是( )
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1=4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9】
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1=4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9】
| A、相同条件下,pH相同的NaClO和Na2CO3溶液,物质的量浓度前者小于后者 |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 |
| D、氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂时,粗盐水中可先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后滤去沉淀,所得滤液中仍含有一定量的SO42- |
催化剂的研究是化学反应原理中的一个重要领域,下列有关叙述正确的是( )
| A、加催化剂可以增大或减小化学反应的焓变 |
| B、某反应的△H=+100 kJ?mol-1,则正反应活化能比逆反应活化能小100 kJ?mol-1 |
| C、任何化学反应都需要活化能的推动 |
| D、对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比例 |
标准状况下,下列物质体积最大的是( )
| A、2gH2 |
| B、20gSO2 |
| C、23gNa |
| D、160gBr2 |