题目内容
10.下列离子方程式或化学方程式与所述事实相符且正确的是( )| A. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.过氧化钠在离子反应中保留化学式;
B.向0.1 mol•L-1、pH=1的NaHA溶液完全电离出氢离子;
C.以金属银为阳极电解饱和硫酸铜溶液,阳极Ag失去电子;
D.加入Ba(OH)2溶液SO42-使完全沉淀,反应生成硫酸钡、氢氧化铝和一水合氨.
解答 解:A.H${\;}_{2}^{18}$O中投入Na2O2固体的离子反应为2H${\;}_{2}^{18}$O+2Na2O2═4Na++2OH-+218OH-+O2↑,故A错误;
B.向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液的离子反应为H++OH-═H2O,故B正确;
C.以金属银为阳极电解饱和硫酸铜溶液的离子反应为Cu2++2Ag$\frac{\underline{\;电解\;}}{\;}$2Cu+2Ag+,故C错误;
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
5.X元素原子的第二层比Y元素原子的第二层少3个电子,X元素原子核外电子总数比Y元素原子核外电子总数少5个,则X和Y可能形成的化合物是( )
| A. | 离子化合物Y(XO3)2 | B. | 离子化合物Y2X3 | C. | 共价化合物Y3X2 | D. | 共价化合物XY2 |
19. 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
(1)以下可能引起细颗粒物指标变高的是abdef(填序号).
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)如图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值. 随后NO2约于10:00达峰值,其主要反应的方程式可能为2NO+O2=2NO2.8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关:O+O2→O3,该反应物中游离的氧原子主要是由反应:NO2=NO+O产生的.O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2.你认为该地光化学烟雾较严重的时间最可能为c(填序号).
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2与N2O4的平衡混合物密度为3.18g/L时,混合气体的平均摩尔质量为77.9g/mol,N2O4的分解率(即转化率)为53.1%.(计算结果均保留三位有效数字).
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题.NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq)═N2(g)+2H2O(l)可加快该反应的措施为升温、增大反应物浓度.该反应的反应速率方程为ν=k•c(NH4+)x•c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
据表知,将溶液稀释至原体积的2倍,反应速度将变为原来的$\frac{1}{4}$.
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:(1)以下可能引起细颗粒物指标变高的是abdef(填序号).
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)如图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值. 随后NO2约于10:00达峰值,其主要反应的方程式可能为2NO+O2=2NO2.8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关:O+O2→O3,该反应物中游离的氧原子主要是由反应:NO2=NO+O产生的.O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2.你认为该地光化学烟雾较严重的时间最可能为c(填序号).
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2与N2O4的平衡混合物密度为3.18g/L时,混合气体的平均摩尔质量为77.9g/mol,N2O4的分解率(即转化率)为53.1%.(计算结果均保留三位有效数字).
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题.NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq)═N2(g)+2H2O(l)可加快该反应的措施为升温、增大反应物浓度.该反应的反应速率方程为ν=k•c(NH4+)x•c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |


 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.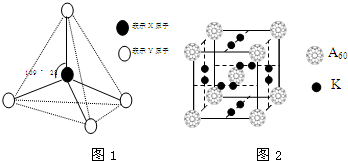 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态. .
.