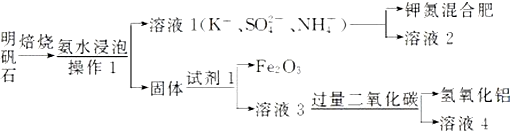
题目内容
17.下列叙述正确的是( )| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
分析 A.酸性氧化物与水反应只生成酸;
B.过氧化钠具有氧化性,能够氧化二价铁离子生成三价铁;
C.氨气和氯化氢气体反应生成氯化铵为气态反应;
D.依据二氧化硫的还原性解答.
解答 解:A.二氧化氮与水反应生成硝酸和一氧化氮,所以不属于酸性氧化物,故A正确;
B.Na2O2粉末加入到FeSO4溶液中,生成氢氧化铁红褐色沉淀,同时生成氧气,故B错误;
C.氨气和氯化氢气体反应生成氯化铵为气态反应,没有离子参加,不是离子反应,故C错误;
D.往酸性KMnO4溶液中通入SO2,高锰酸钾褪色,体现二氧化硫的还原性,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉酸性氧化物、离子反应的概念、过氧化钠、二氧化硫性质是解题关键,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 汽油是纯净物 | |
| B. | 天然气是可再生能源 | |
| C. | 煤的干馏是化学变化 | |
| D. | 石油的分馏、裂化、裂解均是化学变化 |
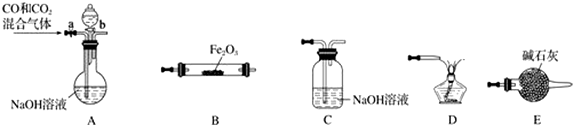
5.某课外实验小组设计的下列实验合理的是( )
| A. |  制备少量氨气 | B. |  吸收HCl | ||
| C. |  分离苯和乙醇的混合物 | D. |  制备并收集少量NO2气体 |
12.25℃时,在①0.01mol/L的盐酸,②pH=2的醋酸,③pH=12的氨水,④0.01mol/L的NaOH溶液4种溶液中,由水电离出的c(H+)的大小关系是( )
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
9.钛是航空、军工、电力等领域的重要原料.工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
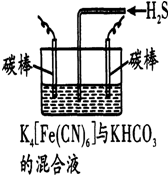
5. 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A. | 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | |
| B. | 断开K1,闭合K2时,铜电极作正极 | |
| C. | 断开K2,闭合K1时,石墨电极附近溶液变红 | |
| D. | 断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2H+ |
 铁和铜是人类使用最早的金属,铁、铜及其化合物在工农业生产等许多领域中有着重要的作用.
铁和铜是人类使用最早的金属,铁、铜及其化合物在工农业生产等许多领域中有着重要的作用.