题目内容
探究铁矿石中铁的含量
将2.25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL,利用反应 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 对铁矿石中铁元素的含量进行测定.
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是 .
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56) .
③在本实验的滴定过程中,下列操作会使测定结果偏小的是 (填写序号).
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出.
将2.25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL,利用反应 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 对铁矿石中铁元素的含量进行测定.
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56)
③在本实验的滴定过程中,下列操作会使测定结果偏小的是
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出.
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:①准确配制一定物质的量浓度的溶液可以用容量瓶来配制,准确度高;
②根据反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,可得出6Fe2+~Cr2O72-;
③a、未用标准K2Cr2O7溶液润洗滴定管,则消耗的标准K2Cr2O7溶液偏多;
b.锥形瓶中加入待测溶液后,再加少量水,不影响滴定结果;
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出,则消耗的标准K2Cr2O7溶液偏少.
②根据反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,可得出6Fe2+~Cr2O72-;
③a、未用标准K2Cr2O7溶液润洗滴定管,则消耗的标准K2Cr2O7溶液偏多;
b.锥形瓶中加入待测溶液后,再加少量水,不影响滴定结果;
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出,则消耗的标准K2Cr2O7溶液偏少.
解答:
解:①准确配制一定物质的量浓的溶液可以用容量瓶来配制,准确度高,故答案为:100mL容量瓶;
②根据反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,可得出6Fe2+~Cr2O72-,消耗 K2Cr2O7溶液体积为25.00mL时,物质的量为:0.0150mol/L×0.025L=0.000375mol,铁矿石中铁元素的百分含量是:
×100%=56%,故答案为:56%;
③a、未用标准K2Cr2O7溶液润洗滴定管,相当于将之稀释,则消耗的标准K2Cr2O7溶液偏多,结果偏高,故a不选;
b.锥形瓶中加入待测溶液后,再加少量水,不影响滴定结果,故b不选;
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出,待测液中的溶质减少,则消耗的标准K2Cr2O7溶液偏少,结果偏低,故c选;
故答案为:c.
②根据反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,可得出6Fe2+~Cr2O72-,消耗 K2Cr2O7溶液体积为25.00mL时,物质的量为:0.0150mol/L×0.025L=0.000375mol,铁矿石中铁元素的百分含量是:
| 0.000375mol×6×56g/mol |
| 0.225g |
③a、未用标准K2Cr2O7溶液润洗滴定管,相当于将之稀释,则消耗的标准K2Cr2O7溶液偏多,结果偏高,故a不选;
b.锥形瓶中加入待测溶液后,再加少量水,不影响滴定结果,故b不选;
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出,待测液中的溶质减少,则消耗的标准K2Cr2O7溶液偏少,结果偏低,故c选;
故答案为:c.
点评:本题是一道考查铁的化学性质以及滴定实验的结果误差分析的综合题目,考查角度广,难度大.

练习册系列答案
相关题目
工业上由重晶石制取可溶性钡盐,对已经粉碎后的矿石首先进行的处理方法应是( )
| A、水溶法 | B、酸溶法 |
| C、碱溶法 | D、还原法 |
下列除杂质(括号内为杂质)方法合理的是( )
| A、Fe3+(Fe2+),加过量铁粉,过滤 |
| B、Mg2+(Al3+),加过量氨水,过滤 |
| C、CO2(HCl),通过碳酸钠饱和溶液,洗气 |
| D、固体Na2CO3(NaHCO3),加热至恒重 |





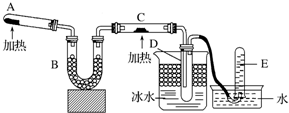 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.

 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: