题目内容
3. 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)
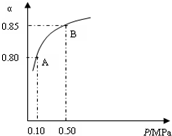
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于800.
②平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOX可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
分析 (1)利用三段式法计算平衡浓度,根据平衡常数表达式计算,温度不变,则平衡常数K不变;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热,结合元素的化合价变化计算转移的电子数.
解答 解:(1)①由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
K=$\frac{{c}^{2}(S{O}_{3})}{c(S{O}_{2})c({O}_{2})}$=$\frac{(0.16)^{2}}{(0.04)^{2}×0.02}$=800,
故答案为:800;
②平衡常数只受温度的影响,温度不变,则平衡常数不变,压强增大平衡状态由A变到B时,则k(A)=k(B),
故答案为:=;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
n(CH4)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
整个过程中转移的电子总数为:0.20mol×8NA=1.60NA,
放出的热量为:0.2mol×867kJ/mol=173.4kJ,
故答案为:1.60NA(或1.6NA);173.4.
点评 本题考查化学平衡及化学反应及能量,题目难度中等,本题易错点为化学平衡常数的计算,注意计算过程的把握.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
| A. | 两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 途径Ⅰ到达平衡所用时间一定等于途径Ⅱ到达平衡所用时间 | |
| D. | 达平衡时,途径Ⅰ所得混合气体的密度等于途径Ⅱ所得混合气密度的一半 |

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
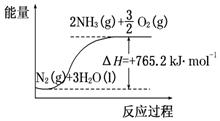 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
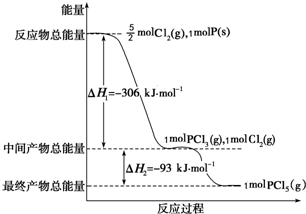 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据). 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.