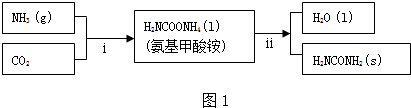
题目内容
10.某温度下,在一个2L的密闭容器中,加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
分析 恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,反应方程式为:3A(g)+2B(g)?4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应了(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
由气体物质的量之比等于压强之比可得反应后气体物质的量为$\frac{4}{5}$×(4+2)=4.8mol,所以D为气体、C是非气体,
A.根据非气体量的改变不影响平衡移动;
B.根据转化率=$\frac{物质转化量}{物质的起始量}$×100%计算;
C.根据化学平衡常数与温度有关,温度不变,K不变;
D.根据非气体不写入化学平衡常数的表达式.
解答 解:反应方程式为:3A(g)+2B(g)?4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应了(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
由气体物质的量之比等于压强之比可得反应后气体物质的量为$\frac{4}{5}$×(4+2)=4.8mol,所以D为气体、C不是气体:
A.由于C的状态不是气体,增大C的量,对平衡没有影响,B的平衡转化率不变,故A正确;
B.达到平衡时生成1.6molC,B的物质的量为0.8mol,则B的转化率为:$\frac{0.8mol}{2mol}$×100%=40%,故B错误;
C.该反应是个气体体积减少的反应,增大该体系的压强,平衡向右移动,但由于温度没变,化学平衡常数不变,故C错误;
D.由于C的状态不是气体,则平衡常数表达式中C不能出现在表达式中,故D错误.故选A.
点评 本题考查了平衡计算以及平衡常数表达式、转化率、平衡常数的影响因素,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数的概念及表示方法.

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2 (g)+3H2(g)?CH3OH g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收 a kJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•S)
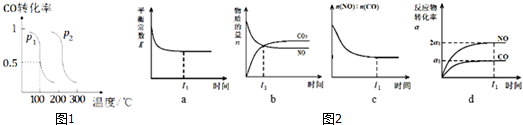
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)?CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示.请回答:①该反应属于放(填“吸”或“放”)热反应;p1 <p2(填“>”、“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示).
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| A. | 在限量范围内使用不会对人体造成危害 | |
| B. | 只有不法商贩才使用食品添加剂 | |
| C. | 不使用食品添加剂的纯天然食品最安全 | |
| D. | 食品添加剂就是为食品好卖出 |
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
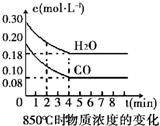
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.