题目内容
5.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题.下列有关对盐水解性质的利用描述中不正确的是( )| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
分析 A、碳酸钠水解呈碱性,加热促进水解,有利于除去油污;
B、铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,据此分析;
C、铵根离子水解显酸性,可以和氧化铁反应;
D、氯化铁与铜反应生成氯化亚铁和氯化铜.
解答 解:A、碳酸钠水解呈碱性,加热促进水解,且油污在碱性条件下水解,有利于除去油污,故A正确;
B、铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,则AlCl3溶液和Na2S水溶液混合发生的反应为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,不能制得Al2S3,故B正确;
C、氯化铵中铵根离子水解显酸性,可以和铁锈成分氧化铁反应,盐的水解有关,故C正确;
D、氯化铁与铜反应生成氯化亚铁和氯化铜,反应化学方程式:2FeCl3+Cu=2FeCl2+CuCl2,和盐的水解无关,故D错误;
故选D.
点评 本题考查了盐的水解原理的应用,题目难度不大,注意发生相互促进的水解时反应能完全进行到底生成沉淀和气体.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
16.下列对能量转化的认知中,正确的是( )
| A. | 电解水生成H2和O2时,化学能主要转化为电能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,热能主要转化为化学能 | |
| D. | 白炽灯工作时,只发生电能转化为光能 |
13.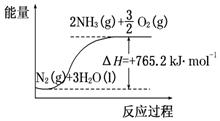 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
20.在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.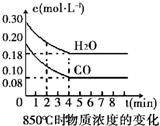
①表中3min-4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
10.在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,则与5molCr3+反应所需PbO2的物质的量为( )
| A. | 7.5mol | B. | 1.5mol | C. | 3mol | D. | 3.25mol |
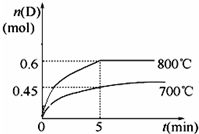
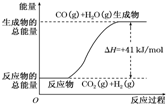 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→