题目内容
18.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是( )①NaHCO3 ②Na2CO3 ③Al2O3 ④Al ⑤Al (OH)3.
| A. | ③④ | B. | ①③④⑤ | C. | ③④⑤ | D. | 全部 |
分析 中学常见能和稀硫酸、氢氧化钠溶液反应的物质有:铝、氢氧化铝、氧化铝、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质,据此分析解答.
解答 解:①NaHCO3 属于弱酸酸式盐,既能与稀硫酸又能与氢氧化钠反应,故符合;
②Na2CO3 能与稀硫酸反应,但不能与氢氧化钠反应,故不符合;
③Al2O3 属于两性氧化物,既能与稀硫酸又能与氢氧化钠反应,故符合;
④Al能与稀硫酸反应深层次硫酸铝与氢气,与氢氧化钠溶液反应生成偏铝酸钠与氢气,故符合;
⑤Al (OH)3属于两性氢氧化物,既能与稀硫酸又能与氢氧化钠反应,故符合,
故选:B.
点评 本题考查元素化合物性质,难度不大,注意归纳总结中学常见能与酸、碱反应的物质.

练习册系列答案
相关题目
8.将铁粉中加入到一定量的CuSO4溶液中充分反应,若在反应过程中有0.2mol 电子发生转移,则反应结束后固体质量增加( )
| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
6.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 常温常压下,11.2L二氧化硫中含有的氧原子数为NA | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数均为2 NA |
13.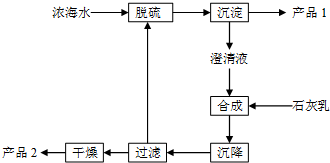 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是 _.
_.
②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 _.
_.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
3.两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
12.已知反应:①101kPa时,2C(s)+O 2(g)═2CO(g)△H=-221kJ•mol-1②稀溶液中,
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列结论正确的是( )
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |


 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.