题目内容
235 92 |
238 92 |
235 92 |
238 92 |
238 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
考点:质子数、中子数、核外电子数及其相互联系,同位素及其应用,同素异形体
专题:
分析:
U中U左下角的数字为质子数,左上角的数字为质量数,原子中质量数=质子数+中子数,具有相同质子数的不同原子互为同位素,同素异形体是指同一元素形成的不同单质.
235 92 |
解答:
解:A、
U原子核中为235-92=143,故A错误;
B、
U原子核中质子数为92,质子数=核外电子数,其核外电子数为92,故B错误;
C、
U与
U的质子数相同,但中子数不同,则应互为同位素,故C正确;
D、同素异形体是指同一元素形成的不同单质,则
U与
U互为同位素,故D错误;
故选C.
235 92 |
B、
235 92 |
C、
235 92 |
238 92 |
D、同素异形体是指同一元素形成的不同单质,则
235 92 |
238 92 |
故选C.
点评:本题考查原子的构成及原子中的量的关系,明确原子构成中不同位置的数字表示的意义、质子数等于核外电子数,质量数=质子数+中子数,同位素和同素异形体的概念即可解答.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
下列物质属于同系物的一组是( )
| A、CH4与C2H4 |
B、 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C、C2H6与C3H8 |
| D、O2与O3 |
常温下,将1体积pH=2.5的盐酸与10体积NaOH溶液混合,两者恰好完全反应,则NaOH溶液的pH等于( )
| A、11.5 | B、10.5 |
| C、9.5 | D、9.0 |
已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、a+3<c-2 |
下列各组元素,氧化性逐渐增强的一组是( )
| A、I2、Br、Cl2、F2 |
| B、F2、Cl2、Br2、I2 |
| C、F-、Cl-、Br-、I- |
| D、Li、Na、K、Rb |
目前人类已发现的非金属除稀有气体外共有16种,下列对这16种非金属元素的相关判断正确的是( )
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
| A、①②④ | B、②③⑤ |
| C、③⑤ | D、①④ |
下列叙述中不正确的是( )
| A、HClO4的酸性比H2SO4强 |
| B、硫化氢的稳定性比氯化氢的强 |
| C、钠与硫化合时生成硫化钠 |
| D、氯气的氧化性比单质硫的强 |
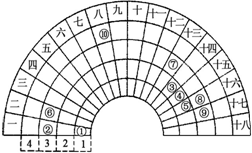 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 |
| B、⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C、元素⑩处于常见周期表第四周期第VIIIB族 |
| D、①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |