题目内容
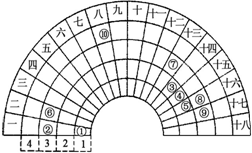 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 |
| B、⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C、元素⑩处于常见周期表第四周期第VIIIB族 |
| D、①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
考点:元素周期表的结构及其应用
专题:
分析:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.根据物质的晶体类型分析,离子晶体熔点高于分子晶体;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.H与C、N、O可以形成离子化合物NH4NO3.
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.根据物质的晶体类型分析,离子晶体熔点高于分子晶体;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.H与C、N、O可以形成离子化合物NH4NO3.
解答:
解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.氯化镁属于离子晶体,而氯化铝属于分子晶体,故氯化镁的熔点更高,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.H与C、N、O可以形成NH4NO3,分子中都含有极性键、离子键,故D正确.
故选D.
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.氯化镁属于离子晶体,而氯化铝属于分子晶体,故氯化镁的熔点更高,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.H与C、N、O可以形成NH4NO3,分子中都含有极性键、离子键,故D正确.
故选D.
点评:本题考查元素周期表的结构及应用,为高频考点,把握扇形元素周期表与常见元素周期表的关系为解答的关键,注意B选项中氯化铝是共价化合物,属于分子晶体.,题目难度不大.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
镍氢电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
235 92 |
238 92 |
235 92 |
238 92 |
238 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
| A、元素原子的核外电子排布呈周期性变化 |
| B、元素的原子半径呈周期性变化 |
| C、元素的化合价呈周期性变化 |
| D、元素的金属性、非金属性呈周期性变化 |
下列说法正确的是( )
| A、离子化合物中一定含离子键,也可能有共价键 |
| B、所有非金属之间形成的化学键一定是共价键 |
| C、电子数相同的两种微粒一定是同一元素 |
| D、共价化合物中一定无离子键 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: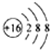 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
下列关于某温度下一定浓度氨水的说法正确的是( )
| A、NH3?H2O电离达到平衡的标志是溶液呈电中性 | ||
B、
| ||
| C、氨水促进了水的电离 | ||
D、c(NH
|

 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成