题目内容
7. (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,氧化产物为SO2和Fe3O4,若有3mol FeS2参加反应,转移32mol电子.
②与明矾相似,硫酸铁也可用作净水剂,其原理为:Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2.
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
①S2O82-+2I-=2SO42-+I2 ②I2+2S2O32-=2I-+S4O62-
S2O82-、S4O62-、I2氧化性强弱顺序S2O82->I2>S4O62-.
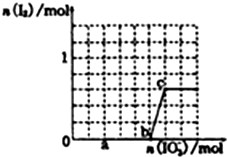
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.
①a点处的还原产物是:I-(填离子符号);
b点→c点反应的离子方程式是IO3-+6H++5I-=3H2O+3I2.
②当溶液中的I-为0.5mol时、加入的KIO3可能是0.5或1.1mol.
分析 (1)①反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
②Fe3+水解生成Fe(OH)3胶体可以净水;
③氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质;
(2)反应方程式为S2O82-+2I-═2SO42-+I2①、I2+2S2O2-3═2I-+S4O62-②,根据氧化剂的氧化性大于氧化产物的氧化性分析;
(3)还原性HSO-3>I-,首先发生反应:IO3-+3HSO3-═I-+3SO42-+3H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
①结合图中a点碘的量判断发生的反应,所含元素化合价降低的元素被还原生成还原产物,据此解答;由图可知,b点到c点有碘生成,应发生IO3-+6H++5I-=3H2O+3I2;
②当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应IO3-+3HSO3-═I-+3SO42-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-);
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,计算HSO3-反应完毕生成n(I-)、消耗的n(KIO3),进而计算反应IO3-+6H++5I-=3H2O+3I2中消耗的I-、KIO3的物质的量,据此计算.
解答 解:(1)①反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;
因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol.
故答案为:SO2和Fe3O4;32;
②Fe3+水解生成Fe(OH)3胶体可以净水,Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
③氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(2)反应方程式为S2O82-+2I-═2SO42-+I2①、I2+2S2O2-3═2I-+S4O62-②,根据氧化剂的氧化性大于氧化产物的氧化性,可知氧化性:S2O82->I2>S4O62-;
故答案为:S2O82->I2>S4O62-;
(3)还原性HSO-3>I-,首先发生反应:IO3-+3HSO3-═I-+3SO42-+3H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
①由图可知,a点没有生成碘,故发生反应IO3-+3HSO3-═I-+3SO42-+3H+,I元素的化合价降低,生成I-为还原产物,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2,
故答案为:I-;IO3-+6H++5I-=3H2O+3I2;
②当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应IO3-+3HSO3-═I-+3SO42-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-=3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×$\frac{1}{5}$=0.1mol,故共加入的KIO3为1mol+0.1mol=1.1mol,
故答案为:0.5或1.1;
点评 本题综合考查氧化还原反应、元素化合物知识,为高频考点,侧重学生的分析、计算能力的考查,注意把握物质的性质,难度不大.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
| A. | C2H6 | B. | C2H4O2 | C. | C2H6O | D. | C2H4Cl2 |
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
 .
.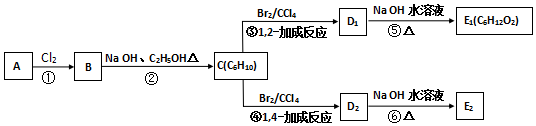
 ,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是
,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是 ,②的反应类型是消去反应.
,②的反应类型是消去反应. +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$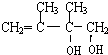 +2NaBr.
+2NaBr. 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题: