题目内容
实验室中常用MnO2或KMnO4等与浓盐酸反应以制取氯气.现用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的浓盐酸.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
请回答下列问题:
(1)所用浓盐酸的物质的量浓度为 .
(2)如用15.8gKMnO4,则理论上能使 克HCl发生上述反应;反应中被氧化的HCl的物质的量为 ;产生的Cl2在标准状况下的体积为 .
(3)制备氯气时,可用NaOH溶液吸收尾气,下列试剂中也含有可用于吸收氯气的物质.
a.Na2SO4溶液 b.FeCl3溶液 c.KNO3溶液 d. Na2S溶液
写出你选择的吸收试剂与Cl2反应的离子方程式: .
请回答下列问题:
(1)所用浓盐酸的物质的量浓度为
(2)如用15.8gKMnO4,则理论上能使
(3)制备氯气时,可用NaOH溶液吸收尾气,下列试剂中也含有可用于吸收氯气的物质.
a.Na2SO4溶液 b.FeCl3溶液 c.KNO3溶液 d. Na2S溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)根据c=
计算浓盐酸的物质的量浓度;
(2)根据方程式计算参加反应HCl的物质的量、生成氯气的物质的量,根据m=nM计算参加反应HCl的质量;被氧化的HCl生成氯气,根据氯原子守恒计算被氧化的HCl,根据V=nVm计算氯气的体积;
(3)氯气具有氧化性,可以用硫化钠溶液吸收,氯气与氯化钠反应深层次氯化钠与硫.
| 1000ρω |
| M |
(2)根据方程式计算参加反应HCl的物质的量、生成氯气的物质的量,根据m=nM计算参加反应HCl的质量;被氧化的HCl生成氯气,根据氯原子守恒计算被氧化的HCl,根据V=nVm计算氯气的体积;
(3)氯气具有氧化性,可以用硫化钠溶液吸收,氯气与氯化钠反应深层次氯化钠与硫.
解答:
解:(1)根据c=
可知,密度为1.19g/cm3,溶质的质量分数为36.5%的浓盐酸的物质的量浓度为
mol/L=11.9mol/L,
故答案为:11.9mol/L;
(2)设HCl的质量为x,氯气的物质的量为y,则:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2×158g 16×36.5g 5mol
15.8g x y
x=
=29.2g,
y=
=0.25mol,
被氧化的HCl生成氯气,根据氯原子守恒,被氧化的HCl为0.25mol×2=0.5mol,生成氯气的体积为0.25mol×22.4L/mol=5.6L,
故答案为:29.2;0.5mol;5.6L;
(3)氯气具有氧化性,可以用硫化钠溶液吸收,氯气与氯化钠反应深层次氯化钠与硫,反应离子方程式为:Cl2+S2-=2Cl-+S↓,故答案为:Cl2+S2-=2Cl-+S↓.
| 1000ρω |
| M |
| 1000×1.19×36.5% |
| 36.5 |
故答案为:11.9mol/L;
(2)设HCl的质量为x,氯气的物质的量为y,则:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2×158g 16×36.5g 5mol
15.8g x y
x=
| 15.8g×16×36.5g |
| 2×158g |
y=
| 15.8g×5mol |
| 2×158g |
被氧化的HCl生成氯气,根据氯原子守恒,被氧化的HCl为0.25mol×2=0.5mol,生成氯气的体积为0.25mol×22.4L/mol=5.6L,
故答案为:29.2;0.5mol;5.6L;
(3)氯气具有氧化性,可以用硫化钠溶液吸收,氯气与氯化钠反应深层次氯化钠与硫,反应离子方程式为:Cl2+S2-=2Cl-+S↓,故答案为:Cl2+S2-=2Cl-+S↓.
点评:本题考查物质的量浓度计算、氧化还原反应计算、离子方程式书写等,难度中等,注意理解物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
在下列各组物质中,属于同系物的是( )
A、 和 和 |
| B、丙烷和2,2-二甲基丙烷 |
| C、乙二醇和丙三醇 |
| D、1,1-二氯乙烷和1,2-二氯乙烷 |
性质决定用途,化学知识运用得当可以使人类的生活更美好.下列物质性质与应用的对应关系正确的是( )
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、浓硫酸具有酸性,可用于刻蚀玻璃制品 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
在11Na、12Mg、13Al、14Si、15P、16S、17Cl、18Ar八种元素中,能用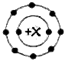 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )
 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )| A、1种 | B、2种 | C、3种 | D、4种 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0 的化学反应下列叙述不正确的是( )
A、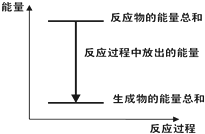 反应过程中能量关系可用如图表示 |
| B、△H的值与反应方程式的计量系数有关 |
| C、若将该反应设计成原电池锌为负极 |
| D、若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L |
下列关于电解质溶液中离子数目的判断正确的是( )
| A、0.1L 3.0mol/L的NH4NO3溶液中含有的NH4+的数目为0.3NA |
| B、等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA |
| C、0.1mol/L的NaHSO4溶液中,阳离子的数目之和为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |
