题目内容
下列每组分别给出了两个量,其中可以组成一个物质的量公式的组合是( )
| ① | ② | ③ | ④ | ⑤ |
| 物质的微粒数 | 固体体积 | 标况下气体摩尔体积 | 溶质的质量分数 | 非标况下物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 标况下气体体积 | 溶液的体积 | 物质的摩尔质量 |
| A、①③⑤ | B、②③④ |
| C、①④⑤ | D、①③④ |
考点:物质的量的相关计算
专题:计算题
分析:①根据微粒数目和物质的量的关系公式N=nNA分析;
②根据m=ρV、n=
来分析;
③根据标准状况下的气体体积和物质的量的关系公式V=nVm来分析;
④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量;
⑤根据质量与物质的量的关系公式m=nM分析.
②根据m=ρV、n=
| m |
| M |
③根据标准状况下的气体体积和物质的量的关系公式V=nVm来分析;
④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量;
⑤根据质量与物质的量的关系公式m=nM分析.
解答:
解:①根据N=nNA,利用物质的粒子数(N)、阿伏加德罗常数(NA)可以计算物质的量,由n=
可知,故①正确;
②由m=ρV,n=
可知,利用体积、密度只能计算其质量,但摩尔质量(M)未知,则不能计算出其物质的量,故②错误;
③根据V=nVm,利用标准状况下的气体摩尔体积(Vm)、标准状况下的气体体积(V)可以计算物质的量n=
可知,故③正确;
④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量,故④错误;
⑤由n=
可知,利用物质的质量与摩尔质量可以计算其物质的量,故⑤正确;
故选A.
| N |
| NA |
②由m=ρV,n=
| m |
| M |
③根据V=nVm,利用标准状况下的气体摩尔体积(Vm)、标准状况下的气体体积(V)可以计算物质的量n=
| V |
| Vm |
④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量,故④错误;
⑤由n=
| m |
| M |
故选A.
点评:本题考查以物质的量为中心的基本计算,理解掌握计算公式即可解答,题目比较基础.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
一种常见液态烃,它不跟溴水反应,但能使KMnO4酸性溶液褪色.0.05mol该烃完全燃烧时生成8.96L CO2(标准状况),该烃是 ( )
| A、C4H8 |
| B、C8H16 |
C、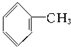 |
D、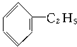 |
下列递变规律正确的是( )
| A、HClO4、H2SO4、H3PO4的酸性依次增强 |
| B、P、S、Cl最高正价依次降低 |
| C、钠、镁、铝的还原性依次减弱 |
| D、HCl、HBr、HI的稳定性依次增强 |
某气态烃在一个密闭容器中和过量的氧气混合完全燃烧,反应后测得容器内压强不变(温度为120℃),此气态烃为( )
| A、CH4 |
| B、C2H4 |
| C、C3H6 |
| D、C3H8 |
酒精燃烧的化学方程式为:C2H6O+3O2═2CO2+3H2O,完全燃烧一定量的无水酒精,放出的热量为Q,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50ml时恰好生成正盐.则燃烧1mol无水酒精所放出的热量为( )
| A、0.2Q | B、0.1Q |
| C、5Q | D、10Q |
有Mg、Al、Cu、Ag4种金属的混合物,可以用盐酸把它们分为两组,a、d和b、c.如果在上述溶液中加入足量的NaOH溶液,可得到c离子的沉淀;这四种金属两两组成原电池时,a都是正极;如果用a,b,c,d来表示4种金属的顺序,则下列顺序正确的是( )
| A、Mg,Al,Cu,Ag |
| B、Cu,Mg,Al,Ag |
| C、Ag,Al,Mg,Cu |
| D、Cu,Ag,Mg,Al |
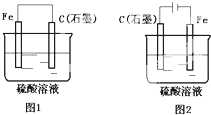 如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )
如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )| A、两装置中,铁电极上均有气体产生 |
| B、两装置中,石墨电极上均有气体产生 |
| C、石墨电极上发生的电极反应均为:2H++2e-=H2↑ |
| D、随着反应的进行,两装置中电解质溶液的酸性均减弱 |
水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14下列叙述正确的是( )
| A、c(H+)随着温度的升高而降低 |
| B、35℃时纯水中c(H+)>c(OH-) |
| C、向水中加入NaHSO4溶液会抑制水的电离 |
| D、向水中加入NaHCO3溶液会抑制水的电离 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃1.01×105Pa?64克SO2中含有的原子数为3NA |
| C、22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、CO和N2分子含有的电子数相同,22.4L的CO气体与lmol N2所含的电子数相等 |