题目内容
8.下列电子式中,正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A、NH4Cl为离子化合物;
B、Na2O中2个钠离子;
C、Na2O2中含2个钠离子和1个O22-;
D、CaCl2中含1个Ca2+和2个Cl-.
解答 解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故A错误;
,故A错误;
B、氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ,
,
故B错误;
C、过氧化钠是离子化合物,由2个钠离子与1个过氧根构成,电子式为; ,故C正确;
,故C正确;
D、氯化钙为离子化合物,电子式中需要标出阴阳离子所带电荷,氯化钙的电子式为: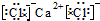 ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
相关题目
8.有10.3克NaBr样品溶于水后,加入足量AgNO3溶液,最终得到19克沉淀,则NaBr中可能混有的杂质是( )
| A. | KBr | B. | LiBr | C. | NaF | D. | MgBr2 |
3.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | Cl2 | CO2 | CaCl2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl |
| A. | ②③④ | B. | ②③④⑤ | C. | ①③④ | D. | ①③④⑤ |
17.下列关于胶体,判断不正确的是( )
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
18.用下列实验装置进行相应实验,能达到实验目的是( )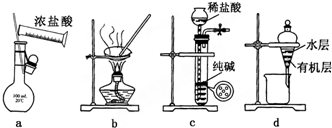

| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
 X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题: .
.