题目内容
6.将1.85g含锌、铁、铜的合金放入足量的盐酸中,反应完毕后,得448mL(标况)氢气,关于此合金的组成,下列说法中不正确的是( )| A. | 合金中铁、锌的物质的量之和为0.02mol | |
| B. | 合金中铜的质量无法确定 | |
| C. | 合金中铁、铜的物质的量之和为0.01mol | |
| D. | 1.30g>铁和锌质量之和>1.12g |
分析 Cu与盐酸不反应,Zn、Fe与盐酸反应生成氢气,n(氢气)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒可知,Zn、Fe的物质的量之和为0.02mol,以此来解答.
解答 解:A.n(氢气)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒可知,Zn、Fe的物质的量之和为$\frac{0.02mol×2×(1-0)}{(2-0)}$=0.02mol,故A正确;
B.Zn、Fe的物质的量不确定,则Cu的质量无法确定,故B正确;
C.由选项A可知,Zn、Fe的物质的量之和为0.02mol,故C错误;
D.若与盐酸反应的金属只有Zn,其质量为0.02mol×65g/mol=1.30g,若与盐酸反应的金属只有Fe,其质量为0.02mol×56g/mol=1.12g,而Zn、Fe均反应,则1.30g>铁和锌质量之和>1.12g,故D正确;
故选C.
点评 本题考查混合物的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法及极限法应用,题目难度不大.

练习册系列答案
相关题目
14.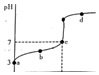 R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
 R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A. | a点表示溶液中c(CH3COO-)-定为10-3 mol/L | |
| B. | b点表示的溶液中c(Na+)<c(CH3COO-) | |
| C. | c点表示CH3COOH和NaOH恰好反应完全 | |
| D. | d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$大于K |
1.下列有关化学用语使用正确的是( )
| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
11.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O所含原子个数大于3NA | |
| B. | 100ml18.4mol/L硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 100g质量分数为34.2%的蔗糖分子水溶液中含H原子数为2.2NA |
18.下列操作中,不会发生明显颜色变化的是( )
| A. | FeSO4溶液中滴加NaOH浓液 | B. | 碳酸氢钠溶液中滴加稀盐酸溶液 | ||
| C. | 硫酸铁溶液中滴加硫氰化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
8.工业上用铁屑还原法制备碘化钠的主要流程如图:
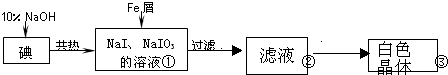
(1)碘元素位于周期表中第五周期,第ⅦA族;
(2)反应①的化学方程式3I2+6NaOH═5NaI+NaIO3+3H2O;
(3)判断反应①中碘是否已完全反应的操作是取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是隔绝空气;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性.
限选试剂:1mol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
要得到更纯的NaI,还需进一步的操作是重结晶(填操作名称)

(1)碘元素位于周期表中第五周期,第ⅦA族;
(2)反应①的化学方程式3I2+6NaOH═5NaI+NaIO3+3H2O;
(3)判断反应①中碘是否已完全反应的操作是取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是隔绝空气;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性.
限选试剂:1mol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
9.三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB- (少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC.则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:A.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
 .
.