题目内容
8.对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是:①锌片溶解了32.5g;②锌片溶解了65g;③铜片上析出lg H2;④铜片上析出1mol H2( )| A. | ①和④ | B. | ①和③ | C. | ②和③ | D. | ②和④ |
分析 该原电池中Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,所以负极金属质量减少、正极析出氢气,以此解答该题.
解答 解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为Zn+H2SO4=ZnSO4+H2↑,
设当导线中有1mol电子通过时,理论上负极锌片溶解x g,铜片上析出氢气y g,
Zn+H2SO4=ZnSO4+H2 ↑ 转移电子
65g 2g 2mol
x y 1mol
x=32.5g
y=1g
故选B.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析、计算能力的考查,明确正负极上发生的反应是解本题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17. 利用原电池原理除去废水中的乙酸钠和对氯酚(
利用原电池原理除去废水中的乙酸钠和对氯酚( ),其原理如图所示,下列说法不正确的是( )
),其原理如图所示,下列说法不正确的是( )
 利用原电池原理除去废水中的乙酸钠和对氯酚(
利用原电池原理除去废水中的乙酸钠和对氯酚( ),其原理如图所示,下列说法不正确的是( )
),其原理如图所示,下列说法不正确的是( )| A. | 电流方向从A极沿导线流向B极 | |
| B. | 每转移2mole-,有0.25mol CH3COO-被氧化 | |
| C. | 当外电路中有2mole-转移时,进入A极区的H+的个数为2NA | |
| D. | A极的电极反应式为 +H++e-═Cl-+ +H++e-═Cl-+ |
18. 其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )
其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )
 其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )
其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )| A. | 若 T1>T2,则正反应是吸热反应 | |
| B. | 达到平衡时,A2转化率:b>a>c | |
| C. | 在 T2和起始 n(A2)不变时达到平衡,n(AB3)大小为:c>b>a | |
| D. | 若 T2>T1,达到平衡时 b、d 两点的反应速率为:d>b |
16.有机物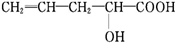 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
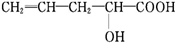 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )| A. | ①④⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②③④ |
3.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 石英、玛瑙的主要成分是二氧化硅,陶瓷、分子筛主要成分是硅酸盐 |
13.下列实验过程中,始终无明显现象的是( )
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | 乙烯通入溴的CCl4溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
20. 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
(1)基态E原子的核外电子排布式为1s22s22p63s23p63d54s1;基态D原子核外电子占据的能量最高的能级符号为3p.
(2)A元素的各级电离能如表:
分析表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是硼原子失去第3个电子后,达到稳定结构,不易再失去电子.
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2.
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是NC13(填分子式).
(5)(DC)4为热色性固体,且有色温效应.低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是分子间作用力;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是共价键.在B、C、D的简单气态氢化物中,属于非极性分子的是CH4(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是NH3.
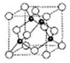
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示.已知:该晶体密度为ρg•cm-3,NA代表阿伏伽德罗常数的值.
①该晶体的化学式为BN.
②在该晶体中,A与C形成共价键的键长(d)为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm.
 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.(1)基态E原子的核外电子排布式为1s22s22p63s23p63d54s1;基态D原子核外电子占据的能量最高的能级符号为3p.
(2)A元素的各级电离能如表:
| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2.
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是NC13(填分子式).
(5)(DC)4为热色性固体,且有色温效应.低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是分子间作用力;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是共价键.在B、C、D的简单气态氢化物中,属于非极性分子的是CH4(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是NH3.
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示.已知:该晶体密度为ρg•cm-3,NA代表阿伏伽德罗常数的值.
①该晶体的化学式为BN.
②在该晶体中,A与C形成共价键的键长(d)为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm.
18.下列表示物质结构的化学用语正确的是( )
| A. | H2O2的电子式: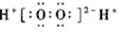 | B. | CCl4的电子式: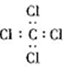 | ||
| C. | ${\;}_{\;}^{18}$O的原子结构示意图: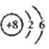 | D. | MgCl2的电子式: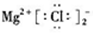 |
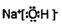 .
.