题目内容
18. 其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )
其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )| A. | 若 T1>T2,则正反应是吸热反应 | |
| B. | 达到平衡时,A2转化率:b>a>c | |
| C. | 在 T2和起始 n(A2)不变时达到平衡,n(AB3)大小为:c>b>a | |
| D. | 若 T2>T1,达到平衡时 b、d 两点的反应速率为:d>b |
分析 A.若T1>T2,说明温度升高时AB3的体积分数越小;
B.B2的物质的量越大,A2转化率越大;
C.在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,据此判断a、b、c时n(AB3)大小
D.温度越高,反应速率越快.
解答 解:A.若T1>T2,T1时AB3的体积分数较小,说明升高温度平衡向着时AB3的体积分数较小的方向移动,则该反应为放热反应,故A错误;
B.增大B的物质的量可以提高A2的转化率,则A2转化率:c>b>a,故B错误;
C.在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,则n(AB3)逐渐增大,即n(AB3)大小为:c>b>a,故C正确;
D.若T2>T1,b点温度较高,则达到平衡时b、d两点的反应速率为:b>d,故D错误;
故选C.
点评 本题考查化学反应速率及化学平衡图象,为高频考点,侧重考查学生的分析能力,明确横坐标为反应物B2的物质的量及该反应可能为吸热反应,也可能为放热反应是解答本题的关键,题目难度较大,为易错题.

练习册系列答案
相关题目
9.如图是研究铁被海水腐蚀的实验装置.图2中M是某种与铁片紧贴的金属,下列说法正确的是( )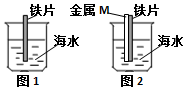

| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
6.0.1moL/L醋酸用蒸馏水稀释的过程中,下列说法正确的是( )
| A. | 电离程度增大,H+浓度增大 | B. | 电离程度减小,H+浓度减小 | ||
| C. | 电离程度增大,H+浓度减小 | D. | 电离程度减小,H+浓度增大 |
13.A、B、C、D均为短周期主族元素,原子序数依次增大,其质子的最外层电子数之和为18,A和C同主族,B原子的电子层数与最外层电子数相等,D元素最高正价与最低负价的绝对值之差为6.下列说法不正确的是( )
| A. | A的一种单质具有良好的导电性 | |
| B. | 氧化物对应水化物的酸性:D>A | |
| C. | B、C的单质均可与NaOH溶液反应生成氢气 | |
| D. | A、B、C三种元素均可以与D元素形成共价化合物 |
4.甲、乙两个烧瓶收集等量的NO2气体并密封,又知2NO2?N2O4△H<0,将甲置于热水中,乙置于冷水中.下列有关现象描述中正确的是( )
| A. | 甲颜色加深 | B. | 乙颜色加深 | C. | 甲、乙颜色都加深 | D. | 甲、乙颜色都变浅 |

 .
. .
. 碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题: