题目内容
在0.5mol CaCl2中含有的Cl-的数目约为( )
| A、3.01×1023 |
| B、6.02×1023 |
| C、3.01×1022 |
| D、6.02×1022 |
考点:物质的量的相关计算
专题:计算题
分析:CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,所以1molCaCl2中含有的Cl-为2mol,根据N=n×NA进行计算;
,所以1molCaCl2中含有的Cl-为2mol,根据N=n×NA进行计算;
 ,所以1molCaCl2中含有的Cl-为2mol,根据N=n×NA进行计算;
,所以1molCaCl2中含有的Cl-为2mol,根据N=n×NA进行计算;解答:
解:CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,所以1molCaCl2中含有的Cl-为2mol,0.5mol CaCl2中含有的Cl-为1mol,含有的Cl-的数目约为N=n×NA=1mol×6.02×1023mol-1=6.02×1023,
,所以1molCaCl2中含有的Cl-为2mol,0.5mol CaCl2中含有的Cl-为1mol,含有的Cl-的数目约为N=n×NA=1mol×6.02×1023mol-1=6.02×1023,
故选B.
 ,所以1molCaCl2中含有的Cl-为2mol,0.5mol CaCl2中含有的Cl-为1mol,含有的Cl-的数目约为N=n×NA=1mol×6.02×1023mol-1=6.02×1023,
,所以1molCaCl2中含有的Cl-为2mol,0.5mol CaCl2中含有的Cl-为1mol,含有的Cl-的数目约为N=n×NA=1mol×6.02×1023mol-1=6.02×1023,故选B.
点评:本题考查了氯化钙的构成,掌握CaCl2是离子化合物以及其电子式是解答的关键,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以42He形式存在,下列说法中正确的是( )
| A、42He原子核内含有 4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以He很容易失去电子,具有较强的金属性 |
下列表示对应化学反应的离子方程式正确的是( )
| A、向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| B、NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
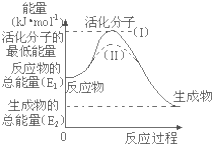 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
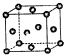 已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.
已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.
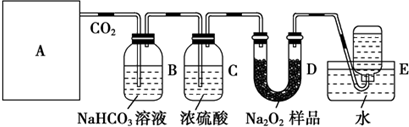
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.