题目内容
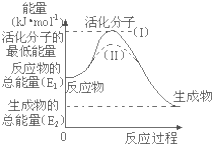 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.(1)如图中反应是
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能
考点:化学反应的能量变化规律
专题:
分析:(1)从图上分析,反应物能量高于生成物,反应放热;反应热等于生成物与反应物的能量差;
(2)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂.
(2)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂.
解答:
解:(1)图示反应是放热反应,反应热等于生成物与反应物的能量差,即E1-E2,
故答案为:放热;E1-E2;
(2)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;
故答案为:降低;加快;使用催化剂.
故答案为:放热;E1-E2;
(2)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;
故答案为:降低;加快;使用催化剂.
点评:本题考查了化学反应能量变化分析,活化能概念的理解应用,化学平衡影响因素的分析判断,掌握基础是关键,题目难度不大.

练习册系列答案
相关题目
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中正确的是( )
| A、原子序数:B>A>C |
| B、原子半径:A>B>C |
| C、离子半径:A2->C->B2+ |
| D、原子最外层电子数:A>C>B |
下列有关物质的化学用语不正确的是( )
| A、二甲醚的分子式:C2H6O |
B、COCl2分子的结构式: |
| C、醛基的结构简式:-CHO |
D、羟基的电子式: |
下列解释事实或实验现象的离子方程式不正确的是( )
| A、用食醋除去暖水瓶中的水垢,水垢溶解,有无色气泡产生:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O |
| C、向NaHCO3和CaCl2混合溶液中,加入少量NaOH溶液:OH-+HCO3-═CO32-+H2O |
| D、铁与硫酸氢钠溶液反应:Fe+2H+═Fe2++H2↑ |
下列离子方程式正确的是( )
| A、铝与盐酸反应:Al+6H+═Al3++3H2↑ |
| B、CO2通入足量NaOH溶中:CO2+2OH-═CO32-+H2O |
| C、澄清石灰水与盐酸反应:Ca(OH)2+2H+═2H2O+Ca2+ |
| D、碳酸钠与氯化钙混合:Na2CO3+Ca2+═CaCO3↓+2Na+ |
在0.5mol CaCl2中含有的Cl-的数目约为( )
| A、3.01×1023 |
| B、6.02×1023 |
| C、3.01×1022 |
| D、6.02×1022 |
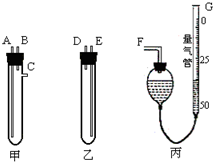 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题: