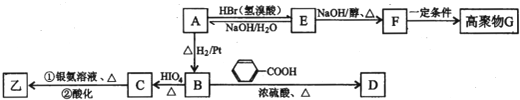
题目内容
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同. | 温度 (℃) | 乙醇转化率 (%) | 有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式
a.乙醇的转化率越高 b.反应进行得越完全 c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量
(5)若用乙醇作为碱性燃料电池的原料,请写出负极的电极反应方程式
考点:化学平衡的调控作用,化学平衡的影响因素
专题:化学平衡专题
分析:(1)分解反应是吸热反应,增大压强平衡向体积减小的方向进行;
(2)根据热化学方程式的书写方法和反应特点分析;
(3)根据化学方程式进行计算,K值越大,表示该反应向正方向进行的程度越大;
(4)根据表中数据解题,选取反应的温度应考虑乙醇的转化率,和乙醚的含量;
(5)乙醇碱性电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水.
(2)根据热化学方程式的书写方法和反应特点分析;
(3)根据化学方程式进行计算,K值越大,表示该反应向正方向进行的程度越大;
(4)根据表中数据解题,选取反应的温度应考虑乙醇的转化率,和乙醚的含量;
(5)乙醇碱性电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水.
解答:
解:(1)分解反应是吸热反应,乙醇脱水制乙烯的反应是分解反应,增大压强平衡向体积减小的方向进行,故向逆反应方向进行.故答案为:吸热;逆向;
(2)1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,分解反应多为吸热反应,该反应的热化学方程式为C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol,
故答案为:C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)反应方程式为2C2H5OH
C2H5OC2H5+H2O,平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,K=
,K值越大,表示该反应向正方向进行的程度越大,乙醇的转化率越高,反应进行得越完全,故答案为:K=
; ab;
(4)乙醚产量应同时考虑乙醇的转化率和乙醚的含量.由表知,150℃时乙醇催化脱水制取的乙醚产量大于125℃时,乙醇制乙醚合适的反应温度区域是 150~175℃,
故答案为:大于;150~175℃;
(5)乙醇燃料电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H6O-12e-+16OH-═2CO32-+11H2O,
故答案为:C2H6O-12e-+16OH-═2CO32-+11H2O.
(2)1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,分解反应多为吸热反应,该反应的热化学方程式为C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol,
故答案为:C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)反应方程式为2C2H5OH
| ||
| 140℃ |
| [C2H5OC2H5]?[H2O] |
| [C2H5OH]2 |
| [C2H5OC2H5]?[H2O] |
| [C2H5OH]2 |
(4)乙醚产量应同时考虑乙醇的转化率和乙醚的含量.由表知,150℃时乙醇催化脱水制取的乙醚产量大于125℃时,乙醇制乙醚合适的反应温度区域是 150~175℃,
故答案为:大于;150~175℃;
(5)乙醇燃料电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H6O-12e-+16OH-═2CO32-+11H2O,
故答案为:C2H6O-12e-+16OH-═2CO32-+11H2O.
点评:本题考查影响平衡的因素、热化学方程式书写、化学平衡常数的含义、电极反应式书写,难度适中,读懂表中数据是解题的关键.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
在0.5mol CaCl2中含有的Cl-的数目约为( )
| A、3.01×1023 |
| B、6.02×1023 |
| C、3.01×1022 |
| D、6.02×1022 |
甲萘醌(维生素K)有止血作用,它可通过2-甲基萘的氧化而制得,反应中常用乙酸作催化剂,该反应放热,可表示为: ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
 ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )| A、使用了过量的氧化剂 |
| B、没有用乙酸,而是使用了其它催化剂 |
| C、把反应混合物加热 |
| D、所生成的甲萘醌是沉淀物 |
下列化学实验事实及其解释或结论都正确的是( )
| A、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 |
| B、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
| C、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH |
| D、向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 |
对于固定体积的密闭容器中进行的气体反应可以说明A(g)+B(g)?C(g)+D(g)在恒温下已达到平衡的是( )
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
| B、10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) |

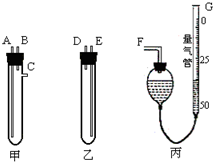 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题: