题目内容
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以42He形式存在,下列说法中正确的是( )
| A、42He原子核内含有 4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以He很容易失去电子,具有较强的金属性 |
考点:质量数与质子数、中子数之间的相互关系,同位素及其应用
专题:
分析:元素符号的左上角表示质量数,左下角表示质子数,中子数=质量数-质子数,质子数=核外电子数;质子数相同,中子数不同的原子互称为同位素;金属性是元素的原子失去电子的能力.
解答:
解:A.24He原子核内含有2个质子,故A错误;
B.32He和24He质子数相同,中子数不同,故互为同位素,故B正确;
C.24He比23He质子数相等都是2,故电子数相等也为2,故C错误;
D.因He原子的结构稳定,既不容易得到电子,也不容易失去电子,故D错误.
故选B.
B.32He和24He质子数相同,中子数不同,故互为同位素,故B正确;
C.24He比23He质子数相等都是2,故电子数相等也为2,故C错误;
D.因He原子的结构稳定,既不容易得到电子,也不容易失去电子,故D错误.
故选B.
点评:本题主要考查了原子符号的含义、核素的种类以及同位素的概念,难度不大,明确氦原子的质子数、同位素的定义、相对原子质量与相对稳定结构是解答本题关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
对于锌、铜和稀硫酸组成的原电池(如图).下列说法正确的是( )


| A、Zn是正极 |
| B、铜是负极 |
| C、铜片上有气泡产生 |
| D、氢离子在铜片表面被氧化 |
下列离子方程式的书写正确的是( )
| A、氯化铵溶液中加入稀氢氧化钠:NH4++OH-═NH3↑+H2O |
| B、硫酸溶液中加入氢氧化钡溶液:SO42-+Ba2++OH-+H+=Ba SO4+H2O |
| C、澄清石灰水中通入过量CO2气体:Ca2++2OH-+CO2═CaCO3↓+H2O |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中正确的是( )
| A、原子序数:B>A>C |
| B、原子半径:A>B>C |
| C、离子半径:A2->C->B2+ |
| D、原子最外层电子数:A>C>B |
有机物的种类繁多,但其命名是有规则的.下列有机物用系统命名法命名正确的是( )
A、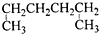 1,4-二甲基丁烷 |
B、 3-甲基丁烯 |
C、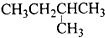 2-甲基丁烷 |
D、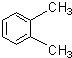 对二甲苯 |
下列溶液中,与100mL 0.5mol?L-1 NaCl溶液所含Cl-物质的量浓度相同的是( )
| A、100 mL 0.5 mol?L-1的MgCl2溶液 |
| B、200 mL 0.25 mol?L-1的CaCl2溶液 |
| C、100 mL 1.0 mol?L-1的NaCl溶液 |
| D、200 mL 0.25 mol?L-1的HCl溶液 |
下列叙述中,正确的是( )
| A、相同质量的水和冰相比较,冰的能量高 |
| B、C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、天然气燃烧要放出热量 |
| D、形成化学键是吸热过程 |
下列有关物质的化学用语不正确的是( )
| A、二甲醚的分子式:C2H6O |
B、COCl2分子的结构式: |
| C、醛基的结构简式:-CHO |
D、羟基的电子式: |
在0.5mol CaCl2中含有的Cl-的数目约为( )
| A、3.01×1023 |
| B、6.02×1023 |
| C、3.01×1022 |
| D、6.02×1022 |