题目内容
3.写出下列烷烃的分子式(1)含有30个氢原子的烷烃C14H30;
(2)假如某烷烃的相对分子质量为142,则该烷烃的分子式为C10H22;
(3)烷烃A在同温同压下蒸气的密度是H2的36倍C5H12;
(4)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L水蒸气C14H30.
分析 烷烃的通式为CnH2n+2,相对分子质量为12n+2n+2,结合C、H原子合数的关系解答该题.
解答 解:烷烃的通式为CnH2n+2,
(1)含有30个氢原子的烷烃,2n+2=30,n=14,则分子式为C14H30,故答案为:C14H30;
(2)某烷烃的相对分子质量为142,12n+2n+2=142,n=10,分子式为C10H22,则故答案为:C10H22;
(3)烷烃A在同温同压下蒸气的密度是H2的36倍,则烷烃的相对分子质量为72,则12n+2n+2=72,n=5,分子式为C5H12,故答案为:C5H12;
(4)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L水蒸气,说明1mol烃生成15mol水,则1mol烃含有30molH原子,则2n+2=30,n=14,分子式为C14H30,
故答案为:C14H30.
点评 本题考查了烷烃分子式的确定,侧重于学生的分析、计算能力的考查,题目难度不大,要求学生掌握烷烃的通式.

练习册系列答案
相关题目
18.甲醇是21世纪应用最广泛的清洁燃料之一,也是农药、医药的重要原料.请回答下列问题:
(1)已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则如图1表示工业上以CO2(g)、H2(g)为原料合成该甲醇反应的能量变化示意图中正确的是a(填字母代号).
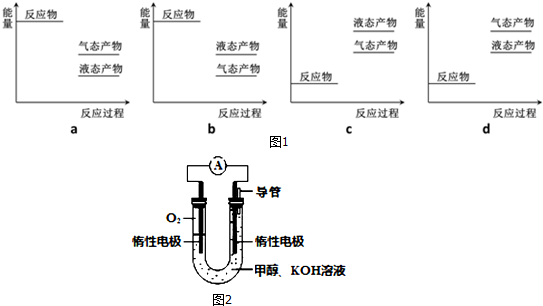
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
①x=0.14.
②若6~8min时只改变了一个条件,则改变的条件是充入一定量H2,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
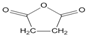
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O;
②该电池工作时,溶液中的OH-向负极移动.
(1)已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则如图1表示工业上以CO2(g)、H2(g)为原料合成该甲醇反应的能量变化示意图中正确的是a(填字母代号).

(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是充入一定量H2,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O;
②该电池工作时,溶液中的OH-向负极移动.
15.2015年8月12日,天津港大爆炸造成巨量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN+H2O2+H2O=NaHCO3+NH3,下列有关说法正确的是( )
| A. | 0.1molNaCN中含共价键数为0.3NA | |
| B. | 0.1mol/LNaHCO3溶液中HCO3-的数目小于0.1NA | |
| C. | 19gH218O2含有的中子数为12NA | |
| D. | 上述反应中,当有22.4LNH3生成时,转移电子数为0.2NA |
15.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(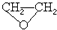 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.
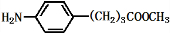
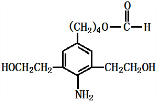
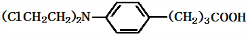 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$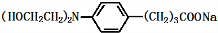 +2NaCl+H2O
+2NaCl+H2O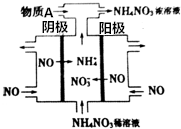 如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:
如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示: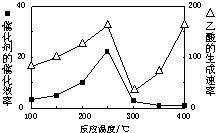 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.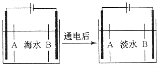 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验: .
.