题目内容
2.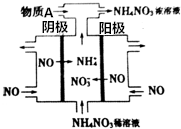 如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:
如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:电源负极反应式为NH4++H2O-5e-=NO+6H+,为使电解产物全部转化为NH4NO3,正极每消耗1molO2,应通入物质A(NH3)0.8mol.(用分数表示)
分析 电解NO制备NH4NO3,由图可知阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,与负极相连的为阴极,根据阴极的反向书写负极反应,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
解答 解:电解NO制备NH4NO3,由图可知阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,与阴极相连的为电源的负极,故电极反应式为NH4++H2O-5e-=NO+6H+,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,正极每消耗1molO2,转移4mol电子,根据氨气通入后转变为铵根离子,
NH4++H2O-5e-=NO+6H+,设需要xmol氨气,根据得失电子守恒知,$\frac{5}{1}=\frac{4}{x}$,x=0.8mol,故答案为:0.8.
点评 本题考查了原电池与电解原理的综合应用,掌握电极方程式的书写和计算,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
12.常温下,有关 0.1mol/LCH3COONa 溶液(pH>7),下列说法不正确的是( )
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
13.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的OH-数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后乙酸断裂的C-O键数目为NA | |
| C. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则 反应过程中被破坏的碳原子之间共用电子对数目为NA | |
| D. | 4.6gSO2、NO2混合气体中含有中子数为2.3 NA |
10.某温度下反应2A(g)?B(g)+C(g)△H<0的平衡常数K=4.此温度下,在1L的密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol•L-1)分别为:0.4,0.6,0.6,下列说法正确的是( )
| A. | 温度升高,该反应反应速率加快,平衡常数增大 | |
| B. | 题目所述的某时刻正、逆反应速率的大小为V(正)>V(逆) | |
| C. | 经10min反应达到平衡,则该时间内反应速率v(A)为0.064mol/(L•min) | |
| D. | 平衡时,再加入与起始等量的A,达新平衡后A的转化率增大 |
7.A、B、C、D、E为原子序数依次增大的元素,只有E不属于短周期,相关信息如下表:
回答下列问题(化学用语中的元素用相应的元素符号表示):
(1)E在元素周期表中的位置是第四周期第ⅤⅢ族.
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度H2O>H2S (氢化物的化学式).
(3)写出B、C形成化合物的电子式: 、
、 .
.
(4)鉴别D的两种氧化物的一种试剂是品红;检验E3+的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)写出A、C的最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH?=AlO2-+2H2O.
| 元素 | A | B | C | D | E |
| 相关 信息 | A元素原子核外有3个电子层,最外层有3个电子. | 与元素C可形成离子个数比 为2:1和1:1的化合物 | C元素的原子K、L层电子数之和比L、M层电子数之和多1个电子 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属, 人体缺少该元素易患贫血症 |
(1)E在元素周期表中的位置是第四周期第ⅤⅢ族.
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度H2O>H2S (氢化物的化学式).
(3)写出B、C形成化合物的电子式:
 、
、 .
.(4)鉴别D的两种氧化物的一种试剂是品红;检验E3+的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)写出A、C的最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH?=AlO2-+2H2O.
 BHC≡CHCCH2=CH2D
BHC≡CHCCH2=CH2D ECH3CH3.
ECH3CH3. .
.