题目内容
15.化学与生产、生活、社会密切相关,下列说法正确的是( )| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
分析 A.淀粉类植物发酵经蒸馏得到乙醇,医用酒精的体积分数75%;
B.废电池深埋,会导致土壤的重金属污染;
C.向海水中加入净水剂明矾只能除去悬浮物杂质;
D.胃溃疡病人服用小苏打易导致胃穿孔.
解答 解:A.75%的酒精为医用酒精,可使蛋白质变性,具有杀菌消毒作用,乙醇可由淀粉类植物发酵经蒸馏制成,故A正确;
B.废电池深埋,会导致土壤的重金属污染,应集中分类回收,故B错误;
C.向海水中加入净水剂明矾只能除去悬浮物杂质,但不能使海水淡化,应用蒸馏的方法,故C错误;
D.碳酸氢钠与盐酸反应生成二氧化碳气体,胃溃疡病人服用小苏打易导致胃穿孔,故D错误.
故选A.
点评 本题综合考查有机物的结构和性质以及元素化合物知识,为高考常见题型,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2,5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断试样的pH约为4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”).
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”).
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
10.某温度下反应2A(g)?B(g)+C(g)△H<0的平衡常数K=4.此温度下,在1L的密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol•L-1)分别为:0.4,0.6,0.6,下列说法正确的是( )
| A. | 温度升高,该反应反应速率加快,平衡常数增大 | |
| B. | 题目所述的某时刻正、逆反应速率的大小为V(正)>V(逆) | |
| C. | 经10min反应达到平衡,则该时间内反应速率v(A)为0.064mol/(L•min) | |
| D. | 平衡时,再加入与起始等量的A,达新平衡后A的转化率增大 |
20.下列说法正确的是( )
| A. | 加热或点燃H2、CO、CH4等可燃性气体参与反应时,都要先检验纯度再加热或点燃. | |
| B. | 将SO2通入酸性高锰酸钾溶液中,紫红色褪去,说明SO2具有漂白性 | |
| C. | KNO3与NaCl的混合物,通过结晶法一次分离就可得到两种纯净物 | |
| D. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氯水,后滴加KSCN溶液 |
7.A、B、C、D、E为原子序数依次增大的元素,只有E不属于短周期,相关信息如下表:
回答下列问题(化学用语中的元素用相应的元素符号表示):
(1)E在元素周期表中的位置是第四周期第ⅤⅢ族.
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度H2O>H2S (氢化物的化学式).
(3)写出B、C形成化合物的电子式: 、
、 .
.
(4)鉴别D的两种氧化物的一种试剂是品红;检验E3+的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)写出A、C的最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH?=AlO2-+2H2O.
| 元素 | A | B | C | D | E |
| 相关 信息 | A元素原子核外有3个电子层,最外层有3个电子. | 与元素C可形成离子个数比 为2:1和1:1的化合物 | C元素的原子K、L层电子数之和比L、M层电子数之和多1个电子 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属, 人体缺少该元素易患贫血症 |
(1)E在元素周期表中的位置是第四周期第ⅤⅢ族.
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度H2O>H2S (氢化物的化学式).
(3)写出B、C形成化合物的电子式:
 、
、 .
.(4)鉴别D的两种氧化物的一种试剂是品红;检验E3+的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)写出A、C的最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH?=AlO2-+2H2O.
4.我国晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又成丹砂”(注:丹砂即硫化汞).下列说法正确的是( )
| A. | 该过程中仅有物理变化,没有化学变化 | |
| B. | 该过程描述的是一个可逆反应的两个方向 | |
| C. | 该过程设计的反应中包括HgS$\frac{\underline{\;\;△\;\;}}{\;}$Hg+S | |
| D. | 水银有毒,所以生活中绝对不能使用 |
 BHC≡CHCCH2=CH2D
BHC≡CHCCH2=CH2D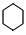 ECH3CH3.
ECH3CH3.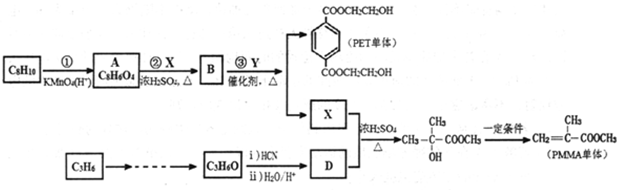
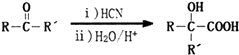
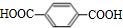 +2CH3OH$→_{△}^{浓硫酸}$
+2CH3OH$→_{△}^{浓硫酸}$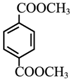 +2H2O.
+2H2O.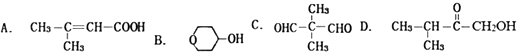
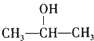 $→_{△}^{O_{2}/Cu}$
$→_{△}^{O_{2}/Cu}$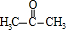 .
.