题目内容
15.2015年8月12日,天津港大爆炸造成巨量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN+H2O2+H2O=NaHCO3+NH3,下列有关说法正确的是( )| A. | 0.1molNaCN中含共价键数为0.3NA | |
| B. | 0.1mol/LNaHCO3溶液中HCO3-的数目小于0.1NA | |
| C. | 19gH218O2含有的中子数为12NA | |
| D. | 上述反应中,当有22.4LNH3生成时,转移电子数为0.2NA |
分析 A.CN-中C原子与N原子之间形成三键;
B.溶液中HCO3-发生水解,其浓度小于0.1mol/L,但溶液体积未知;
C.H218O2分子中含有的中子数为20,计算H218O2的物质的量可得含有中子;
D.反应中C元素化合价由+2价升高到+4价,被氧化,O元素化合价由-1价降低到-2价,被还原,而N元素化合价未变,由于氨气所处状态未知,不能确定氨气的物质的量,即不能确定转移电子.
解答 解:A.CN-中C原子与N原子之间形成三键,0.1molNaCN中含共价键数为0.3NA,故A正确;
B.溶液中HCO3-发生水解,其浓度小于0.1mol/L,溶液中HCO3-的数目还与溶液体积有关,但溶液体积未知,不能确定溶液中HCO3-的数目小于0.1NA,故B错误;
C.19gH218O2的物质的量为$\frac{19g}{38g/mol}$=0.5mol,H218O2分子中含有的中子数为20,故含有中子数为10NA,故C错误;
D.反应中C元素化合价由+2价升高到+4价,被氧化,O元素化合价由-1价降低到-2价,被还原,而N元素化合价未变,由于氨气所处状态未知,不能确定氨气的物质的量,则不能确定参加反应NaCN或H2O2的物质的量,故不能确定转移电子,故D错误.
故选A.
点评 本题考查氧化还原反应计算、物质的量计算、盐类水解等,D选项为易错点,学生容易忽略氨气是否处于标准状况下.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.如表元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.下列说法中不正确的是( )
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
6.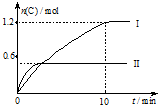 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
实验内容和结果分别如下表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如下表和如图所示.下列说法正确的是( )
| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
3.结构简式为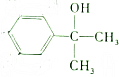 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
10.某温度下反应2A(g)?B(g)+C(g)△H<0的平衡常数K=4.此温度下,在1L的密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol•L-1)分别为:0.4,0.6,0.6,下列说法正确的是( )
| A. | 温度升高,该反应反应速率加快,平衡常数增大 | |
| B. | 题目所述的某时刻正、逆反应速率的大小为V(正)>V(逆) | |
| C. | 经10min反应达到平衡,则该时间内反应速率v(A)为0.064mol/(L•min) | |
| D. | 平衡时,再加入与起始等量的A,达新平衡后A的转化率增大 |
20.下列说法正确的是( )
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
20.下列说法正确的是( )
| A. | 加热或点燃H2、CO、CH4等可燃性气体参与反应时,都要先检验纯度再加热或点燃. | |
| B. | 将SO2通入酸性高锰酸钾溶液中,紫红色褪去,说明SO2具有漂白性 | |
| C. | KNO3与NaCl的混合物,通过结晶法一次分离就可得到两种纯净物 | |
| D. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氯水,后滴加KSCN溶液 |
1.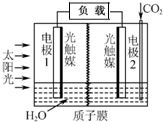 利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
 利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )| A. | 电子由电极1经过负载流向电极2 | |
| B. | 若将质子膜换成阴离子交换膜,该电池依然能够正常工作 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |