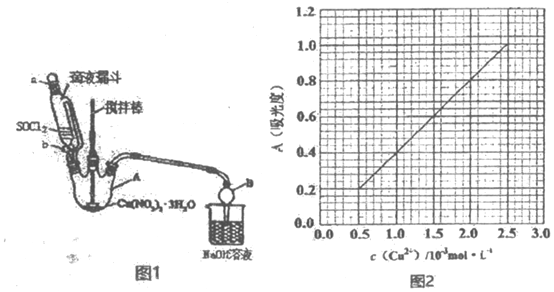
题目内容
11.实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应,原因是什么?分析 配成溶液后再进行化学反应可增大接触面积,提高反应速率.
解答 解:常把固体试剂溶于水配成溶液后再进行化学实验,这样可增大接触面积,提高反应速率,如果不配成溶液后再进行化学反应的话,就属于固相反应,固相反应存在很多缺点,接触不均匀等,液相反应大大优于固相反应,
故答案为:把固体试剂溶于水配成溶液后再进行化学实验,这样可增大接触面积,提高反应速率.
点评 本题考查影响化学反应速率的因素,明确浓度、温度、接触面积、反应物的状态等对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
1.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品不易生锈 | |
| C. | 加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
2. 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 乙醇钠 |
6.我国可燃冰的开采技术领先世界,关于可燃冰的说法正确的是( )
| A. | 可燃冰可能在未来汽车“燃油”替变为“燃冰” | |
| B. | 可燃冰即使开采不当也不会造成“温室效应” | |
| C. | 可燃冰中有一种甲烷气体,甲烷属无机物 | |
| D. | 可燃冰中的乙醚与乙醇互为同分异构体 |
2.下列反应中,氧化剂与还原剂的个数之比为 1:1 的是( )
| A. | Cu+2 H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | 2Na+H2SO4═Na2 SO4+H2↑ | |
| C. | 3S+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O | |
| D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2NaCl |
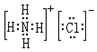 ,其中存在的化学键类型为离子键和共价键.
,其中存在的化学键类型为离子键和共价键.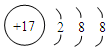 ;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.
;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.