题目内容
6.对下列实验事实的解释或结论不正确的是( )| 选项 | 操作、现象 | 解释或结论 |
| A | 向饱和Na2CO3溶液中通入少量CO2无浑浊出现 | 生成NaHCO3量少未使溶液饱和 |
| B | 用NaOH标准溶液滴定未知浓度盐酸,滴定终点时俯视读数 | 测定盐酸浓度偏低 |
| C | 向氯化钡溶液通入过量SO2无明显现象,再①通氯气②通氨气,两种操作均会产生白色沉淀 | 白色沉淀①为硫酸钡,②为亚硫酸钡 |
| D | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.无浑浊出现,说明生成的碳酸氢钠没有达到饱和;
B.俯视读数,导致最终读数偏低,测定结果偏低;
C.氯气将二氧化硫氧化成硫酸,氨气与二氧化硫反应生成亚硫酸铵;
D.氢氧化钠过量,不能证明溶解度大小.
解答 解:A.向饱和Na2CO3溶液中通入少量CO2无浑浊出现,说明二氧化硫较少,生成的NaHCO3没有达到饱和,故A正确;
B.用NaOH标准溶液滴定未知浓度盐酸,滴定终点时俯视读数,导致读出的标准液体积偏小,测定结果偏低,故B正确;
C.向氯化钡溶液通入过量SO2无明显现象,再①通氯气②通氨气,前者氯气将二氧化硫氧化成硫酸,硫酸与氯化钡生成硫酸钡沉淀,后者氨气与二氧化硫生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡沉淀,故C正确;
D.氢氧化钠过量,不能证明溶解度大小,如加入足量氯化镁完全生成氢氧化镁沉淀后再加入氯化铁,能生成红褐色沉淀,则可证明,故D错误;
故选D.
点评 本题考查较为综合,涉及溶解度、中和滴定、难溶物溶解平衡及沉淀转化等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握实验的角度和原理,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
5.下列物质的每步转化在给定条件下能一步实现且较合理的是( )
| A. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2}•H_{2}O}{→}$HNO3 |
17.充分燃烧一定量的丁烷气体放出的热量为xQ kJ,完全吸收它生成的CO2生成正盐,需5mol•L-1的KOH溶液100mL,则丁烷的燃烧热为( )
| A. | 16xQ kJ•mol-1 | B. | 8xQ kJ•mol-1 | C. | 4xQ kJ•mol-1 | D. | 2xQ kJ•mol-1 |
14.利用有机物X可制取有机物Y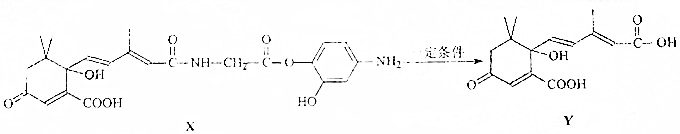
下列说法正确的是( )

下列说法正确的是( )
| A. | X分子中有2个手性碳原子 | |
| B. | X可以发生酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| C. | 1molX与足量NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molY在一定条件下与H2发生加成反应,最多消耗5molH2 |
1.设 NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标况下,1 mol水分子占有的体积为 22.4L | |
| B. | 17g OH-中质子总数比电子总数多 NA | |
| C. | 物质的量浓度为 0.5mol/L的 MgCl2溶液中,含有 Cl-的数目为 NA | |
| D. | 4g氦气中所含氦原子的数目为 NA |
11.部分弱酸的电离常数如表:
下列有关说法不正确的是( )
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 等体积、等浓度的HCOONa和NaCN两溶液中所含阴离子数目相等 | |
| B. | HCOO-、CN-、HS-在溶液中可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+C(S2-) | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
18.下列有关说法不正确的是( )
| A. | 红热的铜丝可以和乙醇发生置换反应产生氢气 | |
| B. | 苯和乙烯都能使溴水褪色,但原理不同 | |
| C. | 淀粉和乙酸乙酯在一定条件下都能发生水解反应 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
2.下列有关物质的性质与应用相对应的是( )
| A. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 | |
| B. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| C. | Fe3+具有氧化性,可溶解印刷线路板上的金属铜 | |
| D. | SO2具有漂白性,能使紫色KMnO4溶液褪色 |