题目内容
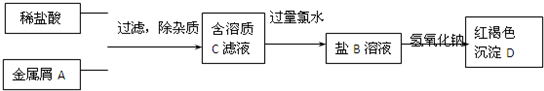
5.下列物质的每步转化在给定条件下能一步实现且较合理的是( )| A. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2}•H_{2}O}{→}$HNO3 |
分析 A.碱式碳酸铜和硫酸反应生成硫酸铜溶液,钠是活泼金属在溶液中先和水反应生成氢氧化钠和氢气;
B.饱和食盐水中通入氨气和二氧化碳生成碳酸氢钠,碳酸氢钠分解生成碳酸钠;
C.海水中加入熟石灰沉淀镁离子生成氢氧化镁沉淀,氢氧化钠分解生成氧化镁和水,氧化镁熔点高,工业上电极氯化镁得到金属镁;
D.氨气氨气催化氧化生成一氧化氮,一氧化氮和氧气混合通入水中生成硝酸.
解答 解:A.钠是活泼金属和盐溶液反应先与水分与生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,不能在溶液中置换铜,故A错误;
B.向氨化的饱和氯化钠溶液中通入二氧化碳反应生成碳酸氢钠晶体和氯化铵,碳酸氢钠受热分解生成碳酸钠,能一步实现,故B正确;
C.海水中含镁离子,加入熟石灰反应生成氢氧化镁沉淀,氢氧化镁受热分解生成氧化镁,氧化镁熔点高不能电解氧化镁制备镁,应是电解熔融氯化镁得到镁,不能一步实现各步转化,故C错误;
D.氮气和氧气混合通入水中不能反应生成硝酸,应是氨气催化氧化生成一氧化氮,一氧化氮和氧气水中全部转化为硝酸,故D错误;
故选B.
点评 本题考查了铁、镁、氨气等物质性质和海水资源的利用,主要是反应条件和产物的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
15.某种医药中间体X,其结构简式如图.下列有关该化合物说法正确的是( )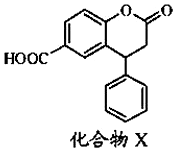

| A. | X的分子式为C16H11O4 | |
| B. | X分子中有3种不同的官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
16.下列指定反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| C. | 用MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO43-+3Cl-+5H2O |
13.下列有关物质的性质与用途具有对应关系的是( )
| A. | 医用酒精能使蛋白质变性,可用于消毒杀菌 | |
| B. | SiO2有很好的折光率,可以用来做半导体材料 | |
| C. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 | |
| D. | 氯化铝是强电解质,可电解其水溶液获得金属铝 |
20.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | Y元素在元素周期表中的位置是第2周期第V族 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 13g苯和乙炔(C2H2)的混合物中含有的碳原子数为NA | |
| B. | 过量铁与标准状况下5.6LCl2充分反应,转移电子数为0.75NA | |
| C. | 0.5mol乙烷中含有的共价键数为3NA | |
| D. | 2L0.5mol/L的Na2CO3溶液中含有的CO32-数目为NA |
5.铁屑和铜屑一起放入稀HNO3中,有少量铜屑剩余,则溶液中可能有的金属离子是( )
| A. | Fe3+和Cu2+ | B. | Fe2+和Cu2+ | C. | Fe2+和Fe3+ | D. | 只有Fe2+ |
6.对下列实验事实的解释或结论不正确的是( )
| 选项 | 操作、现象 | 解释或结论 |
| A | 向饱和Na2CO3溶液中通入少量CO2无浑浊出现 | 生成NaHCO3量少未使溶液饱和 |
| B | 用NaOH标准溶液滴定未知浓度盐酸,滴定终点时俯视读数 | 测定盐酸浓度偏低 |
| C | 向氯化钡溶液通入过量SO2无明显现象,再①通氯气②通氨气,两种操作均会产生白色沉淀 | 白色沉淀①为硫酸钡,②为亚硫酸钡 |
| D | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |